
Гальванический элемент составлен из водородного и нормального каломельного электрода. Напишите схему гальванического элемента. Вычислить рН и рОН, аН+, аОН- раствора в водородном электроде, если известна ЭДС гальванического элемента и наоборот. (Решение → 34002)
Заказ №38828
Гальванический элемент составлен из водородного и нормального каломельного электрода. Напишите схему гальванического элемента. Вычислить рН и рОН, аН+, аОН- раствора в водородном электроде, если известна ЭДС гальванического элемента и наоборот. По условию рН буферного раствора, входящего в водородный электрод 3,5.ЭДС определить Дано: E( Hg| Hg2Cl2)=0,280B, (потенциал нормального каломельного электрода при 1,0M раствора хлорида калия).КС1 рН=3,5 (в водородном электроде) Найти: схема гальванического элемента, ЭДС гальванического элемента, аН+, аОН?
Решение:
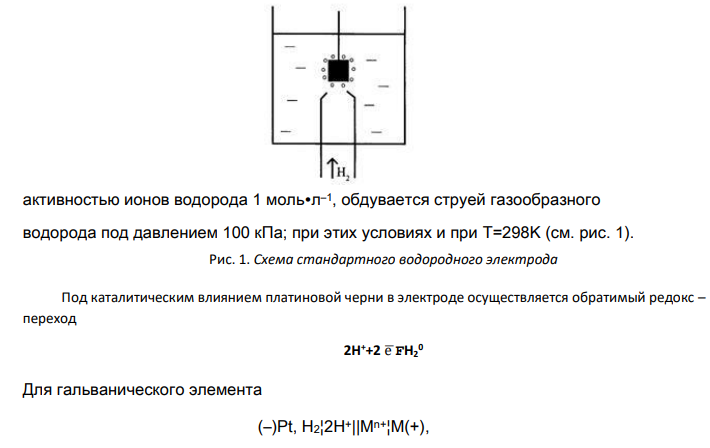
Гальванические первичные элементы - это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Эти источники одноразового действия непрерывного или с перерывами. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Гальванические элементы характеризуются: э.д.с., емкостью, энергией, которую он может отдать во внешнюю цепь, сохранностью. Э.д.с. элемента определяется термодинамическим функциями, протекающих в них процессов; Емкость элемента – это количество электричества, которое источник тока отдает при разряде. Емкость зависит от массы запасенных в источнике реагентов и степени их превращения, снижается с понижением температуры или увеличением разрядного тока; Энергия элемента численно равна произведению его емкости на напряжение. С увеличением количества вещества реагентов в элементе и до определенного предела, с увеличением температуры, энергия возрастает . Энергию уменьшает увеличение разрядного тока; Сохранность – это срок хранения элемента, в течение которого его характеристики остаются в заданных пределах. Сохранность элемента уменьшает увеличение температуры хранения. Гальваническим элементом называется система, составленная из двух разных электродов, обладающая способностью самопроизвольно преобразовывать химическую энергию протекающей в нем окислительно-восстановительной реакции в электрическую энергию. 325 Электроды, из которых составлен гальванический элемент, называются полуэлементами. Протекающая в гальваническом элементе окислительно-восстановительная реакция пространственно разделена. Полуреакция окисления протекает на полуэлементе, называемом анодом (отрицательно заряженном электроде), а полуреакция восстановления - на катоде. Электродвижущая сила (ЭДС) гальванического элемента алгебраически складывается из разностей внутренних потенциалов составляющих его электродов. Поэтому, если в качестве одного полуэлемента взять электрод с известной величиной разности внутренних потенциалов, то по измеренной величине ЭДС можно вычислить искомую разность потенциалов исследуемого электрода. Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T=298K (см. рис. 1). Рис. 1. Схема стандартного водородного электрода Под каталитическим влиянием платиновой черни в электроде осуществляется обратимый редокс – переход 2H++2 е̅FH2 0 Для гальванического элемента (–)Pt, H2¦2H+||Mn+¦M(+), в котором протекает окислительно-восстановительная реакция запишем уравнение изотермы




- Какая из солей K2SО4 СН3СООК (NH4)2SO4 при растворении в воде имеет рН > 7? Составьте уравнение гидролиза для этой соли в ионном и молекулярном виде
- Дать определение оборачиваемости активов. 2. Рассчитать в таблице 1 показатели оборачиваемости капитала и оборотных активов предприятия, долю оборотных активов в общей величине капитала за предыдущий и отчетный год. 3. Определить величину дополнительно привлеченных в оборот (высвобожденных из оборота) оборотных средств в результате замедления (ускорения) их оборачиваемости. 4.
- Инвестор желает вложить денежные средства в строительство предприятия, которое предполагается эксплуатировать 14 лет. Инвестиции, общей суммой 13000 тыс. р., решено вкладывать поэтапно в начале каждого года строительства предприятия в течение 3 лет: в 1-й год — 4000 тыс. р.; во 2-й — 5000 тыс. р.; в 3-й — 4000 тыс. р.
- Основными цехами целлюлозно-бумажного комбината за квартал изготовлено продукции на 1400 тыс. руб, в том числе на внутрипроизводственные нужды израсходовано продукции на 100 тыс. руб., вспомогательными цехами для реализации выработано продукции на 120 тыс. руб., выполнены ремонтные работы по договору на сумму 200 тыс. руб.
- Какое значение рН (больше или меньше 7) имеют растворы солей Li2S, АlCl3, NiSO4 Составьте ионные и молекулярные уравнения гидролиза этих солей.
- Определить структуру имущества предприятия и источников его формирования на начало и на конец отчетного года. Расчеты занести в таблицу 1. 2. Рассчитать величину оборотного капитала, собственного и заемного капитала предприятия на начало и на конец года, определить их динамику и удельный вес в валюте баланса. 3
- При смешивании растворов CuSО4 и K2CO3 выпадает осадок основной соли - гидроксокарбонат меди(II) и выделяется диоксид углерода. Составьте ионное и молекулярное уравнения происходящего гидролиза
- Какой проект следует реализовать компании «Агротехника» в первую очередь, если выгоды от всех проектов приблизительно равны, а затраты распределяются следующим образом: Годы Гусеничный транспорт, тыс. руб. Колесный и гусеничный транспорт, тыс. руб.
- Используя данные бухгалтерского баланса (приложение 1), рассчитать соответствующие коэффициенты двухфакторной модели оценки вероятности банкротства предприятия на начало и конец года, сравнить результаты, охарактеризовать изменения показателя Z на начало и конец периода, определить степень вероятности банкротства и ее изменения,
- Составьте ионные и молекулярные уравнения гидролиза солей Na2CO3, ZnCl2. Какое значение рН (больше или меньше 7) имеют растворы этих солей?
- Рассматривается проект строительства предприятия, которое предполагается эксплуатировать 10 лет. Инвестиции, общей суммой 10 000 тыс. р., решено вкладывать поэтапно в начале каждого года строительства предприятия в течение 3 лет: в 1-й год — 1000 тыс. р.; во 2-й — 4000 тыс. р.;в 3-й — 5000 тыс. р.
- Особенности жидкостей. Современные взгляды на структуру жидкостей.
- При анализе 0,2512г железосодержащей руды на титрование железа (II) израсходовали 28,15мл раствора перманганата калия с титром (T(КМп_O_)), равным 0,002218г/мл.Вычислите массовую долю железа в руде.
- Начальник цеха Рылов был уволен по п.8 ст. 81 Трудового кодекса, за совершение аморального проступка, несовместимого с продолжением данной работы. Причиной увольнения послужило неоднократное появление на работе в нетрезвом виде.
