
Ирина Эланс
0,8881 г органического вещества обработали концентрированной H2SO4 и перевели азот в сульфат аммония, при кипячении которого с концентрированным NaOH был получен аммиак. (Решение → 35705)
Заказ №38763
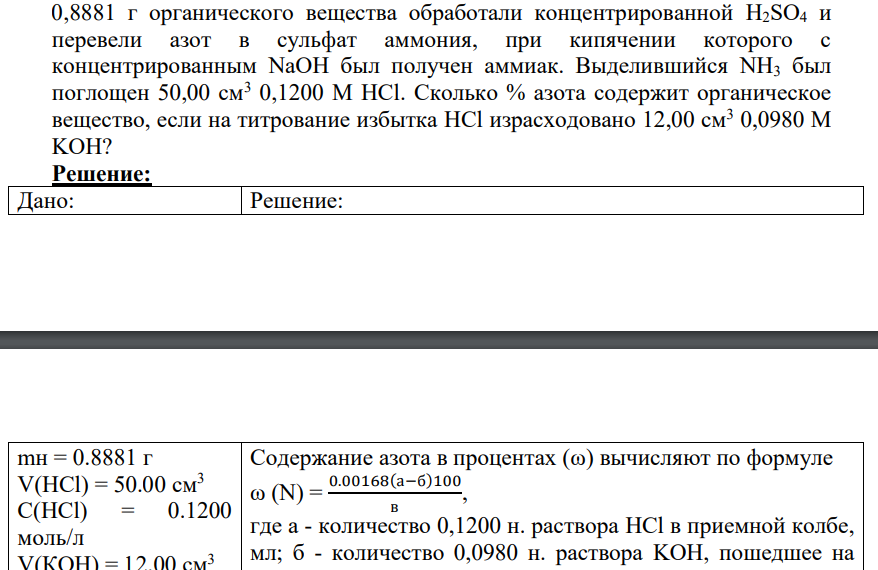
0,8881 г органического вещества обработали концентрированной H2SO4 и перевели азот в сульфат аммония, при кипячении которого с концентрированным NaOH был получен аммиак. Выделившийся NH3 был поглощен 50,00 см3 0,1200 М HCl. Сколько % азота содержит органическое вещество, если на титрование избытка HCl израсходовано 12,00 см3 0,0980 М KOH?Дано:mн = 0.8881 г V(HCl) = 50.00 см3 C(HCl) = 0.1200 моль/л V(КОН) = 12.00 см3 C(КОН) = 0.0980 моль/л
Решение:
Содержание азота в процентах (ω) вычисляют по формуле ω (N) = 0.00168(а−б)100 в , где а - количество 0,1200 н. раствора HCl в приемной колбе, мл; б - количество 0,0980 н. раствора KOH, пошедшее на титрование избытка раствора соляной кислоты,

- При взаимодействии 6,75 г металла с серой образовалось 18,75 г сульфида. Рассчитайте молярные массы эквивалентов металла и его сульфида. Молярная масса эквивалентов серы равна 16 г/моль.
- Полина Е.В., в лице представителя по доверенности Лучина И.Е. обратилась в Свердловский районный суд г. Костромы с исковым заявлением, просит суд, признать брак зарегистрированный Отделом ЗАГС по городскому округу города Кострома Управления ЗАГС по Костромской области Российской Федерации по актовой записи № между Егоровым А.А,, г.р. и Полиной Е.А., г.р., недействительным
- Одна из любовниц императора Коммода была изобличена в участии в заговоре против императора и приговорена к смертной казни. Перед исполнением приговора выяснилось, что она беременна, и казнь была отложена до рождения ребенка
- В городе в 2002г. родилось 40814 детей, в 2003 г. – 41167. В 2003г. умерло 1216 детей в возрасте до 1 года, из них 362 из числа родившихся в 2002г. В 2002 г. умерло 948 детей в возрасте до 1 года, из них 619- из числа родившихся в этом же году. Определите коэффициент младенческой смертности для 2003 года.
- Записать реакции электролиза на инертных электродах и вычислить массу вещества, полученного на катоде, и объем газа, выделившегося на аноде, при электролизе растворов электролитов, если время электролиза 20 минут, сила тока I=2А, если выход по току Вт=100%. Какие вещества будут выделяться на электродах при замене инертного анода на металлический, указанный в задании?
- Пользуясь правилом Гунда, распределите электроны по орбиталям, отвечающим высшему энергетическому состоянию атомов фосфора, алюминия, кремния и никеля. Сколько неспаренных электронов в атомах этих элементов в основном и возбужденном состояниях?
- Препарат применяется при нарушении сердечного ритма (аритмии). Назовите препарат. Проведите качественный анализ (напишите уравнения качественных реакций на катион и анион).
- Дано уравнение реакции (см. вариант 10 в табл. 3) 1. Найдите в прил.1 стандартные энтальпии образования ∆H°(298° K) и стандартные энтропии S° (298° K) для всех веществ, участвующих в реакции.
- Если в разбавленную серную кислоту опустить пластину из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Почему прекращается?
- По данным таблицы 3 рассчитать: 1) коэффициент превышения ПДКсс по i-тому ингредиенту (qi); 2) ИЗА (Ii) отдельным ингредиентом; 3) номер i-того ингредиента в порядке уменьшения Ii (выполнить ранжирование загрязняющих веществ). Указать наиболее опасный из пяти ингредиентов.
- Вычислите степень окисления золота в соединении состава: 64,9% золота и 35,1% хлора. Молярная масса эквивалентов хлора 35,45 г/моль.
- Напишите реакции открытия иона свинца.
- Владелец небольшой фирмы имеет следующие ежегодные затраты: заработная плата наёмным работникам - 540 000 ден. ед., плата за аренду помещении 60 000 ден. ед., расходы на сырье 350 000 ден. ед.. На приобретение производственного оборудования он потратил 360 000 ден. ед. собственных средств, которые при ином размещении могли бы приносить ежегодный доход 36 000 ден. ед.
- В каком направлении сместится равновесие, устанавливающееся в водном растворе иода I, (р) + Н,0 <ж)«±Н01 (р) ♦ HI (р) а) при уменьшении концентрации иода; б) при добавлении в раствор щелочи?
