
1. Приведите определительные уравнения для активности a , средней ионной активности a , средней ионной моляльности m и коэффициента активности сильного электролита. 2. Запишите выражение для ионной силы раствора. (Решение → 33955)
Заказ №38828
1. Приведите определительные уравнения для активности a , средней ионной активности a , средней ионной моляльности m и коэффициента активности сильного электролита. 2. Запишите выражение для ионной силы раствора. Правило ионной силы. 3. Запишите уравнения предельного закона Дебая–Хюккеля, 2-го и 3-го приближений теории Дебая–Хюккеля для водных растворов. 4. Найдите ионную силу раствора электролита А с концентрацией m1 (табл. №2). 5. Используя предельный закон Дебая–Хюккеля рассчитайте средний ионный коэффициент активности при 298 K для электролита А с моляльной концентрацией m1 . 6. Определите m±, m , a и a электролита А в водном растворе с моляльной концентрацией m1 . 7. Вычислите ионную силу раствора электролита А с моляльной концентрацией m1 , если в растворе присутствует электролит В с моляльной концентрацией m2 . 8. По предельному закону вычислите средний ионный коэффициент активности электролита А с моляльной концентрацией m1 при 298 К, если в растворе присутствует электролит В с моляльной концентрацией m2 . 9. На основании справочных данных ([7], табл.№72) о величинах средних ионных коэффициентов активности начертите график lg = f( I ) от m 0 до m 3 . На график нанесите зависимость lg = f( I ) в соответствии с предельным законом Дебая–Хюккеля. 10. Приведите выражение для произведения растворимости малорастворимого соединения D. 11. На основании справочных данных о произведении растворимости соединения D рассчитайте его растворимость: а) в водном растворе этого вещества, б) в присутствии электролита А с моляльной концентрацией m1 . Таблица №2 № варианта Электролит А m1 Электролит В m2 Соединение D 12 KNO3 0,001 LaCl3 0,001 AgCN 362 363
Решение:
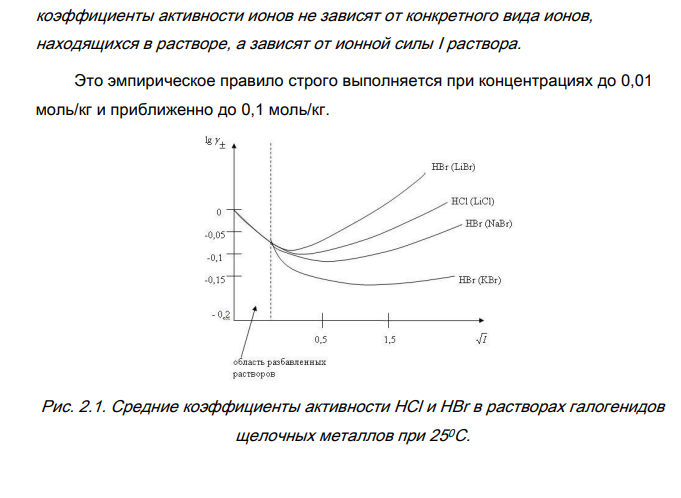
1. Приведите определительные уравнения для активности a , средней ионной активности a , средней ионной моляльности m и коэффициента активности сильного электролита. Различают активность электролита и активность ионов. Для любого электролита процесс диссоциации можно записать следующим образом: 𝐴𝑍 +𝐵𝑍 − ⇄ 𝑛+𝐴 𝑍 + + 𝑛−𝐵 𝑍 − (2.1) где n+ и n– — количество ионов А с зарядом z+ и ионов B c зарядом z–, на которые распадается исходная частица. Для раствора электролита в целом можно записать: mсоли= m0 соли+ RT·ln aсоли, (2.2) С другой стороны химический потенциал электролита складывается из химических потенциалов ионов, так как электролит распадается на ионы: mсоли = n+m++ n- m-, (2.3) m+ и m- относятся к одному молю ионов, mсоли – к одному моль электролита. Подставим выражение (2.3) в (2.2): n+ m+ + n- m- = m0 соли + RT ln aсоли (2.4) Для каждого типа ионов можем записать уравнение типа (2.2): m+= m0 ++ RT·ln a+ (2.5) m-= m0 -+ RT·ln a_ Подставим уравнение (2.5) в левую часть уравнения (2.4) и поменяем местами правую и левую части. m0 с+ RT·lnaс= n+ m0 ++ n+RT·lna++ n–m0 –+ n-RT·lna-(2.6) Объединим все слагаемые с m0 в левой части (m0 с- n+*m0 + - n-*m0 -) = n+ RT·ln a++ n- RT·ln a- - RT·ln aсоли (2.7) Если учесть, что по аналогии с формулой (2.3) m0 С= n+ m0 ++ n- m0 -(2.8) то m0 С - n+ m0 + - n- m0 - = 0 (2.9) 364 Уравнение (2.9) аналогично уравнению (2.2), но оно относится к стандартному состоянию, когда (аС=а+=а-= 1). В уравнении (2.7) правая часть равна нулю, и оно перепишется следующим образом: RT·ln aс = n+ RT·ln a+ + n- RT·ln aln aс = ln a+ n+ + ln a+ nЭто связь активности электролита в растворе с активностями ионов или 𝑎𝑐 = 𝑎+ 𝑛+ ∗ 𝑎− 𝑛− (2.10) где аС— активность электролита, а+ и а– — активности положительных и отрицательных ионов. Нельзя принципиально найти экспериментально активности отдельных ионов, т.к. нужно было бы иметь дело с раствором из одного вида ионов. Это невозможно. Поэтому было введено понятие средней ионной активности 𝑎− +, представляющей собой среднее геометрическое из активности отдельных ионов: 𝑎− + = (𝑎 𝑛 + + + 𝑎 𝑛 − −) 1/𝑛 (2.11) где n=n+.+nили подставив выражение (2.10) имеем: 𝑎− + = √𝑎𝑐 𝑛 ⇔ 𝑎𝑐 = 𝑎± 𝑛 (2.12) Криоскопический метод и метод, основанный на определении давления пара, позволяют определить активность электролита в целом (аС) и по уравнению (2.12) найти среднюю ионную активность. Как известно, активность связана с концентрацией соотношением a=f*m где f – средний коэффициент активности m – моляльность(концентрация) раствора Средний ионный коэффициент активности 𝑓− + определяется выражением, аналогичным выражению для средней ионной активности 𝑓− + = (𝑓 𝑛 + + + 𝑓 𝑛 − − ) 1/𝑛 (2.13) Существуют табличные значения 𝑓− + для различных способов выражения концентраций (моляльность, молярность, мольные доли). 365 Для них 𝑓− +имеет численно разные значения. Экспериментально значения 𝑓− +определяют криоскопическим методом, методом измерения давления пара, методом измерения ЭДС гальванических элементов и др. Аналогично средний ионный стехиометрический коэффициент 𝛾± для сильных электролитов определяется из выражения: 𝛾± = (𝛾 𝑛 + + + 𝛾 𝑛 − − ) 1 𝑛++𝑛− (2.14) Средняя ионная моляльность 𝑚− + определяется как 𝑚− + = (𝑚𝑛 + + + 𝑚𝑛 − −) 1/𝑛 (2.15) Если концентрацию раствора выражать через моляльность, то 𝑎− + = 𝑚− + ∗ 𝑓− + = (𝑚𝑛 + + + 𝑚𝑛 − −) 1/𝑛 ∗ (𝑓 𝑛 + + + 𝑓 𝑛 − − ) 1/𝑛 и, подставив выражения m+=n+*m, m-=n-*m, где m - моляльность раствора, будем иметь: 𝑎− + = 𝑚 ∗ 𝑛− + ∗ 𝑓− + (2.16) 2. Запишите выражение для ионной силы раствора. Правило ионной силы. Концентрацию растворов сильных электролитов можно характеризовать не только активностью а, но и ионной силой. Активность а характеризует концентрацию одного электролита в растворе, а через ионную силу можно выражать концентрацию как одного, так и нескольких электролитов. Таким образом, ионная сила показывает суммарную концентрацию всех электролитов в растворе с учетом взаимодействия между ионами. Ионная сила раствора (I, размерность концентрации) – это полусумма произведений концентраций всех ионов в растворе на квадрат их заряда. 𝐼 = 1 2 ∑𝑚𝑖 ∗ 𝑍𝑖 2 𝐼 = 1 2 ∑𝐶𝑖 ∗ 𝑍𝑖 2 (2.17) где mi=ni*m- моляльность i-го иона; m – моляльность электролита; Zi – заряд i-го иона. От ионной силы раствора зависит γ±. Эта зависимость выражается правилом ионной силы (или закон ионной силы Льюиса и Рендалла): 366 коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от ионной силы I раствора. Это эмпирическое правило строго выполняется при концентрациях до 0,01 моль/кг и приближенно до 0,1 моль/кг. Рис. 2.1. Средние коэффициенты активности HCl и HBr в растворах галогенидов щелочных металлов при 250С. В области концентраций 0,01 – 0,1 моль/кг существуют следующие закономерности: 1.Зависимость 𝑙𝑔𝛾± = −√𝐼 (2.18) линейная, поэтому γ± зависит только от I и не зависит от природы иона; 2. Для соединений одного валентного типа γ± одинаков (т. к. в области низких концентраций тангенс угла наклона прямой одинаков). 3. Запишите уравнения предельного закона Дебая–Хюккеля, 2-го и 3-го приближений теории Дебая–Хюккеля для водных растворов. В 1923 г. Дебай и Гюккель разработали электростатическую теорию растворов сильных электролитов (или теория сильных электролитов ДебаяХюккеля). Теория сильных электролитов Дебая-Хюккеля справедлива только для разбавленных растворов сильных электролитов. Основные положения теории: 367 1. собственными размерами ионов можно пренебречь по сравнению с расстоянием между ними, поскольку растворы разбавленные. 2. учитываются только кулоновские взаимодействия между ионами и не учитываются другие виды взаимодействия (ион-дипольное, образование ассоциатов за счет водородной связи и т. д.) 3. электростатическое взаимодействие между ионами рассматривается как взаимодействие между центральным ионом и его ионной атмосферой. 4. вследствие кулоновского взаимодействия ионы в растворе расположены упорядочено, а растворы являются неидеальными. Ионная атмосфера – представляет собой некоторое усредненное распределение ионов, возникающее вокруг каждого иона (называемого центральным) под влиянием двух факторов – электростатических взаимодействий, которые стараются упорядочить ионы, и теплового движения, стремящегося расположить их хаотически. Ионная атмосфера состоит из ионов противоположных по знаку центральному иону. В отсутствие внешнего электрического поля ионная атмосфера имеет шаровую симметрию, а ее заряд равен по величине и противоположен по знаку заряду центрального иона. Плотность ионной атмосферы уменьшается по мере удаления от центрального иона. Ионную атмосферу можно характеризовать следующими параметрами:











- Фирмаа рассматривает инвестиционный проект, связанный с выпуском продукта «А». Полученные в результате опроса экспертов данные по проекту приведены в таблице. Провести анализ чувствительности (NPV) к изменениям ключевых исходных показателей по формуле:
- Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление - происходит при следующих превращениях: а) Cl- → Cl+7; б) Mn+6 → Mn+2; в) K0 → K+1 .
- Какие из солей - К2СО3, FeCl3, K2SO4, ZnCl2 подвергаются гидролизу? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей.
- Инвестор должен принять решение о вложении денежных средств в строительство предприятия, которое предполагается эксплуатировать 8 лет. Инвестиции, общей суммой 10000 тыс. руб., решено вкладывать поэтапно в начале каждого года строительства предприятия в течение 3 лет: в 1-й год – 5000 тыс.руб.; во 2-й – 0 тыс.руб.; в 3-й – 3000 тыс.руб.
- Какие из солей – KNO3, CrCl3, Cu(NO3)2, NаСN - подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза соответствующих солей.Какие из солей – KNO3, CrCl3, Cu(NO3)2, NаСN - подвергаются гидролизу? Составьте ионные и молекулярные уравнения гидролиза соответствующих солей.
- Составьте молекулярные и ионные уравнения гидролиза солей NiCl2, Na3PO4, NaCl. Какое значение рН (рН ≥7, рН≤7) имеют растворы этих солей?
- Натрия тиосульфат. Способы получения.
- Имеются следующие данные о динамике балансовой стоимости основных фондов (ОФ) предприятия: Дата 1.011.021.031.041.051.061.071.081.091.101.111.1231.12 Ф, млн. руб. 130 128 120 125 135 124 118 115 119 122 128 125 122
- В соответствии с вариантом 1 (табл. 8) определите молярную концентрацию (С), молярную концентрацию эквивалента (Сэк), моляльную концентрацию (Сm), массовую долю (ω) и молярную долю (х) растворенного вещества при указанной в таблице температуре, если одна из этих концентраций и плотность раствора известны Дано: ρ=1,120г/мл C=1,226 моль/л T=200C Найти: х, Сэк, Сm, w
- Годовой выпуск продукции бумажной фабрики в натуральном выражении по бумаге А – 5500 пачек, бумаге Б – 7300 пачек, В – 6000 пачек, Г – 4000 пачек. Оптовая цена за пачку бумаги А – 100 руб., Б – 180 руб., В – 250 руб., Г – 290 руб. Остатки готовой продукции на складе по всем видам продукции на начало планируемого периода составляют 2530 тыс. руб.
- Рассчитать показатели для каждого варианта проекта: А) период окупаемости инвестиций; Б) дисконтированный период окупаемости; В) среднюю норму рентабельности; Г) чистый приведенный доход; Д) индекс прибыльности, если известны следующие условия:
- Пользуясь таблицей констант нестойкости (см. табл.3 Приложений), определите, в каких случаях произойдет взаимодействие между растворами электролитов. Укажите для этих случаев молекулярные и ионные формы уравнений: а) K2[HgBr4] +KCN; б) Na3[Ag(S2O3)2] + KCN; в) [Cu(NH3)4](NO3)2 +KCN; г) K[Ag(NO2)2] + NH4OH; д) [Ni(NH3)4]Cl2 + NaCN.
- При смешивании растворов Al2(SO4)3 и Nа2СО3 каждая из взятых солей гидролизуется необратимо до конца. Составьте ионное и молекулярное равнения происходящего совместного гидролиза.
- Раствор перекиси водорода разв. Окислительно-восстановительные свойства.
