
Краткая характеристика гормонов поджелудочной железы. (Решение → 32987)
Заказ №38761
Краткая характеристика гормонов поджелудочной железы.
Ответ:
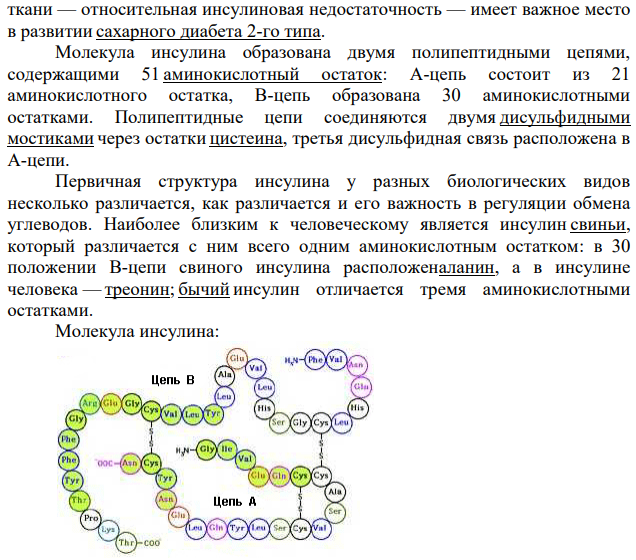
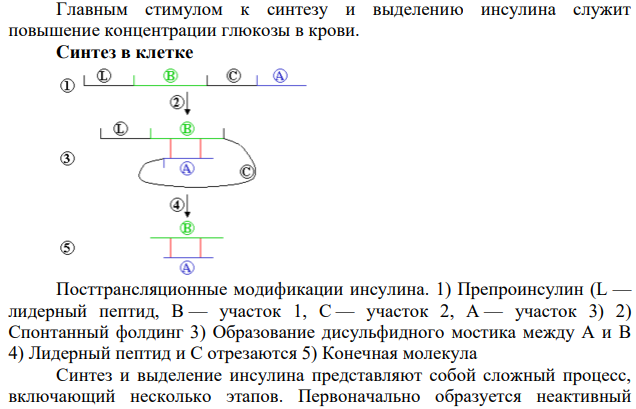
Поджелудочная железа человека (лат. páncreas) — орган пищеварительной системы; крупная железа, обладающая внешнесекреторной и внутреннесекреторной функциями. Внешнесекреторная функция органа реализуется выделением панкреатического сока, содержащего пищеварительные ферменты. Производя гормоны, поджелудочная железа принимает важное участие в регуляции углеводного, жирового и белкового обмена. Внутрисекреторная функция состоит в выработке поджелудочной железой гормонов инсулина и глюкагона, играющих большую роль в регулировании углеводного и липидного обмена. Инсулин вырабатывается в бета-клетках островков Лангерганса. Под влиянием его происходит фиксация гликогена в печени, поглощение тканями сахара из крови и уменьшение липемии. Глюкагон вырабатывается в альфа-клетках островков Лангерганса и действует на содержание сахара в крови противоположным, чем инсулин, образом. Рассмотрим каждый из гормонов по отдельности. Инсулин (от лат. insula — остров) —гормон пептидной природы, образуется в бета-клетках островков Лангергансаподжелудочной железы. Оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови. Считается самым изученным гормоном (более 300 000 цитирований в PubMed). Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков. Кроме того, инсулин подавляет активность ферментов, расщепляющих гликоген и жиры. То есть, помимоанаболического действия, инсулин обладает также и антикатаболическим эффектом. Нарушение секреции инсулина вследствие деструкции бета-клеток — абсолютная недостаточность инсулина — является ключевым звеном патогенеза сахарного диабета 1-го типа. Нарушение действия инсулина на ткани — относительная инсулиновая недостаточность — имеет важное место в развитии сахарного диабета 2-го типа. Молекула инсулина образована двумя полипептидными цепями, содержащими 51 аминокислотный остаток: A-цепь состоит из 21 аминокислотного остатка, B-цепь образована 30 аминокислотными остатками. Полипептидные цепи соединяются двумя дисульфидными мостиками через остатки цистеина, третья дисульфидная связь расположена в A-цепи. Первичная структура инсулина у разных биологических видов несколько различается, как различается и его важность в регуляции обмена углеводов. Наиболее близким к человеческому является инсулин свиньи, который различается с ним всего одним аминокислотным остатком: в 30 положении B-цепи свиного инсулина расположеналанин, а в инсулине человека — треонин; бычий инсулин отличается тремя аминокислотными остатками. Молекула инсулина: Главным стимулом к синтезу и выделению инсулина служит повышение концентрации глюкозы в крови. Синтез в клетке Посттрансляционные модификации инсулина. 1) Препроинсулин (L — лидерный пептид, B — участок 1, C — участок 2, А — участок 3) 2) Спонтанный фолдинг 3) Образование дисульфидного мостика между А и В 4) Лидерный пептид и C отрезаются 5) Конечная молекула Синтез и выделение инсулина представляют собой сложный процесс, включающий несколько этапов. Первоначально образуется неактивный предшественник гормона, который после ряда химических превращений в процессе созревания превращается в активную форму. Инсулин вырабатывается в течение всего дня, а не только в ночные часы. Ген, кодирующий первичную структуру предшественника инсулина, локализуется в коротком плече 11 хромосомы. На рибосомах шероховатой эндоплазматической сети синтезируется пептид-предшественник — т. н. препроинсулин. Он представляет собой полипептидную цепь, построенную из 110 аминокислотных остатков и включает в себя расположенные последовательно: L-пептид, B-пептид, Cпептид и A-пептид. Почти сразу после синтеза в ЭПР от этой молекулы отщепляется сигнальный (L) пептид — последовательность из 24 аминокислот, которые необходимы для прохождения синтезируемой молекулы через гидрофобную липидную мембрану ЭПР. Образуется проинсулин, который транспортируется в комплекс Гольджи, далее в цистернах которого происходит так называемое созревание инсулина. Созревание является наиболее длительным этапом образования инсулина. В процессе созревания из молекулы проинсулина с помощью специфических эндопептидаз вырезается C-пептид — фрагмент из 31 аминокислоты, соединяющий B-цепь и A-цепь. То есть молекула проинсулина разделяется на инсулин и биологически инертный пептидный остаток. В секреторных гранулах инсулин, соединяясь с ионами цинка, образует кристаллические гексамерные агрегаты. Секреция Бета-клетки островков Лангерганса чувствительны к изменению уровня глюкозы в крови; выделение ими инсулина в ответ на повышение концентрации глюкозы реализуется по следующему механизму: Глюкоза свободно транспортируется в бета-клетки специальным белком-переносчиком GluT 2. В клетке глюкоза подвергается гликолизу и далее окисляется в дыхательном цикле с образованием АТФ; интенсивность синтеза АТФ зависит от уровня глюкозы в крови. АТФ регулирует закрытие ионных калиевых каналов, приводя к деполяризации мембраны. Деполяризация вызывает открытие потенциал-зависимых кальциевых каналов, это приводит к току кальция в клетку. Повышение уровня кальция в клетке активирует фосфолипазу C, которая расщепляет один из мембранных фосфолипидов — фосфатидилинозитол-4,5-бифосфат — на инозитол-1,4,5-трифосфат и диацилглицерат. Инозитолтрифосфат связывается с рецепторными белками ЭПР. Это приводит к высвобождению связанного внутриклеточного кальция и резкому повышению его концентрации. Значительное увеличение концентрации в клетке ионов кальция приводит к высвобождению заранее синтезированного инсулина, хранящегося в секреторных гранулах. В зрелых секреторных гранулах кроме инсулина и C-пептида находятся ионы цинка, амилин и небольшие количества проинсулина и промежуточных форм. Выделение инсулина из клетки происходит путём экзоцитоза — зрелая секреторная гранула приближается к плазматической мембране и сливается с ней, и содержимое гранулы выдавливается из клетки. Изменение физических свойств среды приводит к отщеплению цинка и распаду кристаллического неактивного инсулина на отдельные молекулы, которые и обладают биологической активностью. Регуляция Главным стимулятором освобождения инсулина является повышение уровня глюкозы в крови. Дополнительно образование инсулина и его выделение стимулируется во время приёма пищи, причём не только глюкозы или углеводов. Секрецию инсулина усиливают аминокислоты, особенно лейцин и аргинин, некоторые гормоны гастроэнтеропанкреатической системы: холецистокинин, ГИП, ГПП-1, АКТГ, эстрогены, препараты сульфонилмочевины. Также секрецию инсулина усиливает повышение уровня калия или кальция, свободных жирных кислот в плазме крови. Понижается секреция инсулина под влиянием глюкагона. Бета-клетки также находятся под влиянием автономной нервной системы: Парасимпатическая часть (холинергические окончания блуждающего нерва) стимулирует выделение инсулина; Симпатическая часть (активация α2-адренорецепторов) подавляет выделение инсулина. Причём синтез инсулина заново стимулируется глюкозой и холинергическими нервными сигналами.







- Пренебрегая диффузионным потенциалом, сделайте вывод о том, у какого из следующих двух элементов, взятых при одинаковой температуре, э.д.с. больше: а) Сu CuSO4 CuSO4 Cu – Е1 a=0,1 a=1,0 б) Zn ZnSO4 ZnSO4 Zn – Е2 a=0,01 a=0,1
- Факторный анализ фонда заработной платы Таблица 8 Исходные данные для факторного анализа № п/п Показатель Базисный год Отчетный год Абсолютный прирост Относительный прирост
- Определите обобщающие и частные показатели эффективности использования экономических ресурсов на предприятии. Данные для расчета представлены в табл. 1
- Гражданин Ползунков после распития спиртных напитков в кругу своих знакомых у них на квартире возвращался домой в состоянии легкого опьянения. Выходя из автобуса, он оступился, упал в лужу и сильно испачкался. Патрулировавший сотрудник полиции Яшин, увидев его в таком виде, потребовал предъявить документы, которых у Ползункова не оказалось.
- Могут ли в растворе существовать совместно следующие вещества: а) FeCl3 и SnCl2; б) FeSO4 и NaOH; в) FeCl3 и K4[Fe(CH)6]? Ответ мотивируйте, составив уравнения соответствующих реакций.
- Эквивалентная электрическая проводимость при 25ºС для раствора СН3СООН при разведении 32 л равна 9,2 Ом -1 .см2 . Определить удельную электрическую проводимость и степень диссоциации раствора.
- Жесткость некоторого образца воды обусловливается только гидрокарбонатом железа. При кипячении 0,25 л воды в осадок выпадает 4 мг карбоната железа (II). Определите жесткость воды.
- Вычислить суммарную площадь поверхности 2 г платины, раздробленной на правильные кубики с длиной ребра 10-6 см. Плотность платины 21,4г/см3 .
- Определите плановую прибыль от реализации товарной продукции по рыночным ценам, если на начало года остатки нереализованной продукции А составили 960 ед., продукции Б – 740 ед.
- Во сколько раз увеличится скорость прямой реакции 2SO2 + O2= 2SO3 протекающей в закрытом сосуде, если увеличить давление в 5 раз без изменения температуры?
- Может ли гражданин РФ быть ограничен в праве на выезд из Российской Федерации? Кто и в каком порядке оформляет и выдает гражданам документы на выезд из страны и въезд в страну?
- Для физико-химической константы согласно вашему варианту: 1) Составьте гальванический элемент.
- Решите задачу: рассчитайте минимальную летальную дозу(мг, ммоль) тиоридазина (LDmin= 15 мг/кг) и димедрола (LDmin= 25 мг/кг) для ребенка массой 31 кг. Какое из веществ более токсично (сравнение проводите в системе единицSI).
- Пользуясь значениями ΔН° и S°, вычислить ΔG реакции С(графит)+O2 = СO2; ΔН° = -393,5 кДж При каких условиях возможна данная реакция?
