
Рассчитайте рН растворов: (Решение → 32930)
Заказ №38777
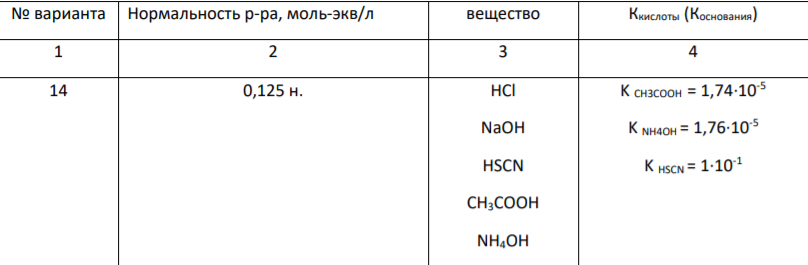
Задача 2 Рассчитайте рН растворов:
Решение
Определим значение водородного показателя данных растворов. Так как предложенные кислоты (HCl, HSCN, CH3COOH) – одноосновные, а основания (NaOH,NH4OH) – однокислотные для данных растворов нормальность раствора равна молярности: См = Сн = 0,125 моль/л.
1) Соляная (HCl) и HSCN - родановодородная (тиоциановая) кислоты – сильные электролиты. Концентрация ионов Сион в растворе электролита зависит от молярной концентрации электролита СМ, его степени диссоциации α и числа ионов данного вида n, получаемых при диссоциации электролита: Сион = См × α ×n. Расчеты без учета ионной силы
а) HCl - сильный электролит, имеется полная диссоциация на ионы. Уравнение диссоциации в водном растворе: HCl → Н+ + ClСогласно уравнению диссоциации, α = 1; n =1, тогда концентрация ионов Н+ в растворе молярной концентрации раствора HCl: С(HCl) = С(Н+) = 0,125 моль/л. Рассчитаем водородный показатель (рН) данного раствора кислоты по формуле: рН = - lg [Н+ ], рН = - lg0,125 = - (-0,9) = 0,9. Следовательно, рН = 0,9 < 7 – среда раствора сильнокислая. Расчеты с учетом ионной силы Для электролитов, состоящих из однозарядных ионов, значение ионной силы раствора численно равно концентрации раствора, в данном случае: Jс = 0,125. Зависимость коэффициента активности от ионной силы очень разбавленного раствора определяется по формуле Дебая-Хюккеля: lg f = - 0,5z2 (Jс) 1/2 . lg f = - 0,5×12 (0,125) 1/2 = - 0,1768, откуда f(Н+ ) = 0,6656; Тогда активная концентрация иона водорода равна: а(Н+) = f × С(иона) = 0,6656×0,125 = 0,0832 моль/л. рН = –lg а(Н+) = –lg 0,0832 = 1,08. рН = 1,08 < 7 – среда раствора сильнокислая (более точное вычисление).
Ответ: без учета ионной силы pH = 0,9; с учетом ионной силы pH = 1,08.
б) Уравнение диссоциации в водном растворе HSCN: HSCN ↔ Н + + SCNОпределим степень электролитической диссоциации HSCN, используя формулу: к ты к ты C K , К – константа диссоциации кислоты, К(HSCN) = 1·10-1 ; С – молярная концентрация раствора кислоты, моль/л. 0,80 1,25 10 1,0 10 1 1 ; С(Н+) = 0,125× 0,8 ×1 = 0,10; рН = - lg0,1= -(-1) = 1. Следовательно, рН = 1 < 7 – среда раствора сильнокислая. 2) NaOH – сильное основание: NaOH ↔ Na+ + OH– Расчеты без учета ионной силы Концентрация гидроксид-ионов в растворе OH– равна молярной концентрации NaOH: [OH– ] = С(NaOH ) = 0,125 моль/л. Гидроксильный показатель раствора рОН определим по формуле: рОН = – ℓg[OH– ] рОН = – ℓg0,125 = - (- 0,9) = 0,9 рН = 14 – рОН = 14 – 0,9 = 13,1 – среда раствора сильно щелочная. Расчет с учетом ионной силы а) По найденной активности а ОН-, вычислим рОН: рОН = - lg а ОНгде а = 0,0832 моль/л – взяли из расчета 1, так как аН+ = а ОН -). рОН = - lg0,0832 = 1,08 б) Находим водородный показатель pH раствора NaOH: pH = 14 – 1,08 = 12,92 – среда раствора сильно щелочная (более точное вычисление). Ответ: без учета ионной силы pH = 13,1; с учетом ионной силы pH = 12,92.
3) Уксусная кислота CH3COOН – слабая одноосновная кислота, поэтому в водных растворах она диссоциирует не полностью по уравнению: CH3COOН ↔ H + + CH3COO- . Выражение для константы диссоциации имеет вид: Ка [ ] [ ] [ ] 3 3 СН СООН Н СН CОО , где Ка – обозначание константы диссоциации слабых кислот (константа кислоткости); КCH3COOН = 1,74·10-5 .




- Осуществите превращения, укажите реагенты и условия ре- 13. акций: a) 1-бромбутан ->1-бутен -> 1-бутин -> этилацетиленид серебра- пентин;
- Определите коэффициенты ввода, выбытия и прироста основных производственных фондов. Исходные данные: стоимость основных производственных фондов на начало года – 20 млн. р;
- Реакция по уравнению 2NO+O2=2NO2 Концентрации исходных веществ были: [NO]= 0,03 моль/л; [O2]=0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,10 моль/л и концентрацию оксида азота до 0,06 моль/л.
- Нарисуйте структурные (графические) формулы следующих соединений.
- Имеются данные о продаже товара по трем филиалам торговой фирмы: Таблица 1 Данные по трем филиалам
- Предприятие закупило линию по производству макаронных изделий для монтажа в своем цехе, перечислив поставщику 88,0 тыс. руб., включая НДС.
- Используя метод молекулярных орбиталей, объясните различную длину связи в молекулах и молекулярных ионах.
- 83, 45 По порядковому номеру элемента составить электронную формулу его атома. Определить природу элемента и валентные электроны.
- При 00С осмотическое давление 0,05М раствора карбоната калия равно 272,5гПа. Определите кажущуюся степень диссоциации K2CO3 в растворе.
- Какие из приведенных гетероциклов можно отнести к ароматическим?
- Получите из ацетилена: б)диэтилацетилен;
- Некоторы газ при давлении 1МПа и температуре 127 имеет удельный объем 0,104 м3/кг. Определить СР/СV газа, если удельная теплоемкость при постоянном давлении равна 910 Дж/кг К. Какой это газ?
- Определите на планируемый период сумму амортизационных отчислений по предприятию. Исходная информация для расчетов приведена в таблице. Таблица Расчет амортизационных отчислений по предприятию на планируемый период, тыс. руб.
- Вычислите процентное содержание растворенного вещества в 0,75н КОН, плотность которого 1,05 г/мл. Дано: Сн(КОН)=0,75 моль-экв/л
