
1) Составьте две схемы коллоидных частиц, образовавшихся из малорастворимого электролита вашего варианта (𝑀𝑔𝐶𝑂3)– частицы одной схемы при электрофорезе движутся к аноду, другой - к катоду. Стабилизирующие электролиты подберите самостоятельно. (Решение → 34794)
Заказ №38828
1) Составьте две схемы коллоидных частиц, образовавшихся из малорастворимого электролита вашего варианта (𝑀𝑔𝐶𝑂3)– частицы одной схемы при электрофорезе движутся к аноду, другой - к катоду. Стабилизирующие электролиты подберите самостоятельно. Обозначьте составные части коллоидных частиц. 2) Опишите условия устойчивости частиц; седиментационная и агрегативная устойчивость; электрокинетические явления, сопровождающие образование коллоидных частиц; лиофильные и лиофобные дисперсные системы; сущность электрофореза и электроосмоса. 3) Коагуляция лиофобных золей электролитами; порог коагуляции, определение и расчёт; подберите коагулянт для вашего золя; рассчитайте порог коагуляции для 10,00 мл золя если концентрация выбранного электролита – коагулянта 0,02 моль/л, а объём, вызывающий заметную коагуляцию равен 2 мл; рассчитайте объёмы электролитов – коагулянтов, если пороги коагуляции 0,2 молярными растворами равны 0,15; 0,750 и 55,00. 4) по данным порогам коагуляции (моль/л) для электролитов KNO3- 50; MgCl2-0,72; Na3O4-43, Na2SO4-49; MgCl2-0,81; AlCl3-0,10 определите знак золя. Ответ обоснуйте.
РЕШЕНИЕ:
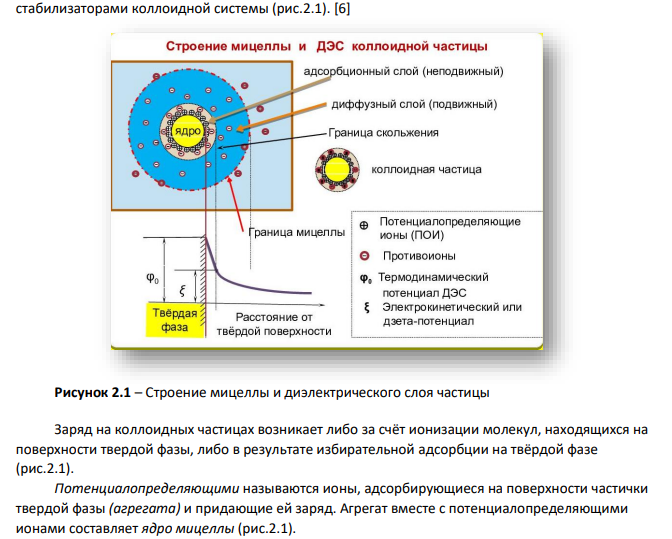
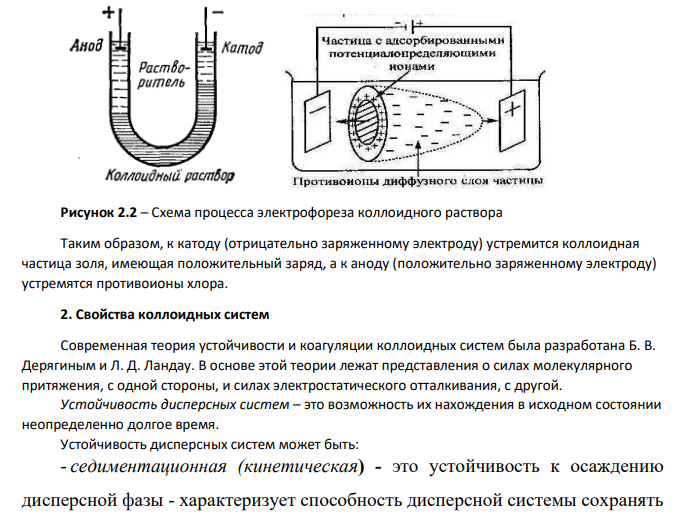
1.Электрофорез коллоидов Дисперсная система — это система, в которой мелкие частицы одного или нескольких веществ равномерно распределены между частицами другого вещества. [6] Дисперсной фазой (ДФ) называют мелкие частицы вещества, которое распределено в системе (рис. 2.1). Дисперсной средой называют вещество, в котором распределена дисперсная фаза (рис. 2.1) Рисунок 2.1 – Схема состава дисперсной системы 76 Дисперсная система может быть гомогенной и гетерогенной. Гомогенная (однородная) дисперсная система – это система, в которой между дисперсной фазой и дисперсионной средой нет поверхности раздела. [6] К таким системам принадлежат истинные растворы. Размеры молекул, ионов меньше, чем 1·10-9м. Такие системы термодинамически устойчивые и понятие дисперсности к ним не относится. Гетерогенная (неоднородная) дисперсная система – это система, в которой частицы дисперсной фазы имеют размер больше чем 1·10-9м и составляют отдельную фазу от дисперсионной среды.[6] Коллоидные системы – системы, размер частиц дисперсной фазы в которых составляет 10- 7– 10-9 м. [6] Коллоидные системы характеризуются гетерогенностью, т.е. наличием поверхностей раздела фаз и очень большим значением удельной поверхности дисперсной фазы. Это обусловливает значительный вклад поверхностной фазы в состояние системы и приводит к появлению у коллоидных систем особых, присущих только им, свойств. Золь – бесструктурный коллоидный раствор, в котором частицы дисперсной фазы слабо взаимодействуют между собой и свободно передвигаются относительно друг друга.[6] В данном случае рассматривается золь карбоната магния, где присутствует жидкая и твердая фаза. Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь (коллоидный раствор) состоит из двух частей: мицелл и интермицеллярной жидкости. Мицелла – это частица дисперсной фазы золя, окруженная двойным электрическим слоем (рис.2.1). Интермицеллярной (межмицеллярной) жидкостью называют дисперсионную среду, разделяющую мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, являющиеся стабилизаторами коллоидной системы (рис.2.1). [6] Рисунок 2.1 – Строение мицеллы и диэлектрического слоя частицы Заряд на коллоидных частицах возникает либо за счёт ионизации молекул, находящихся на поверхности твердой фазы, либо в результате избирательной адсорбции на твёрдой фазе (рис.2.1). Потенциалопределяющими называются ионы, адсорбирующиеся на поверхности частички твердой фазы (агрегата) и придающие ей заряд. Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы (рис.2.1). 77 Противоионы – ионы, группирующиеся вблизи ядра мицеллы (рис.2.1). Расположение противоионов в дисперсионной среде определяется двумя противоположными факторами: тепловым движением (диффузией) и электростатическим притяжением. Противоионы, входящие в состав плотного адсорбционного слоя (рис.2.1), называются «связанными» и вместе с ядром составляют коллоидную частицу, или гранулу (рис.2.1). Коллоидная частица (гранула) имеет заряд, знак которого обусловлен знаком заряда потенциалопределяющих ионов. Частицы дисперсной фазы лиофобных золей имеют сложную структуру, которая зависит от условий получения золей. Рассмотрим в качестве примера структуру мицеллы, образующейся при смешивании растворов карбоната калия и хлорида магния (избыток). Золь карбоната магния получен в результате обменной реакции между карбонатом калия и хлоридом магния. 𝐾2𝐶𝑂3 + 𝑀𝑔𝐶𝑙2 = 𝑀𝑔𝐶𝑂3 ↓ +2𝐾𝐶𝑙 𝑚𝐾2𝐶𝑂3 + (𝑚 + 𝑛)𝑀𝑔𝐶𝑙2 → 𝑚𝑀𝑔𝐶𝑂3 ∗ 𝑛𝑀𝑔2+ + 2𝑛𝐶𝑙− + 2𝑚𝐾 + + 𝑚𝐶𝑂3 2− Катионы магния 𝑀𝑔2+ (потенциалопределяющие ионы ПИ) и анионы 𝐶𝑙 − (противоионы ПИО). В этом случае строение образующихся мицелл отражает следующая схема: Строение мицеллы {⏟𝑚 [𝑀𝑔𝐶 𝑂 3 ] ∙ агрегат 𝑛 𝑀𝑔2+ ∙ 2( 𝑛 − 𝑥) ∙ 𝐶𝑙− ⏟ } адсорбционный слой 2𝑥+ ⏟ коллоидная частица ∙ 2 𝑥 ∙ 𝐶𝑙 ⏟ − диффузный слой мицелла Остальные х противоионы хлора, необходимые для компенсации заряда коллоидной частицы, благодаря диффузии. располагаются вокруг гранулы более рыхло, диффузно. Эти противоионы вместе со своими сольватными оболочками образуют диффузный слой и называются «подвижными» или «свободными» противоионами. Коллоидная частица с окружающим её диффузным слоем сольватированных противоионов составляют мицеллу. В отличие от коллоидной частицы мицелла электронейтральна и не имеет строго определённых размеров. При этом основу коллоидных частиц составят микрокристаллы трудно растворимого карбоната магния 𝑀𝑔𝐶𝑂3, включающие в себя m молекул 𝑀𝑔𝐶𝑂3 (а точнее, m пар ионов 𝑀𝑔2+и 𝐶𝑂3 2−). Эти микрокристаллы называют агрегатами. Если реакция протекает в присутствии избытка хлорида магния, то на поверхности агрегата возникает отрицательно заряженный слой в результате избирательной адсорбции n ионов хлора 𝐶𝑙−. Хлорид-ионы являются потенциалобразующими ионами (сокращенно ПОИ). Агрегат вместе с потенциалобразующими ионами является частицей твердой фазы и его называют ядром. Под действием электростатических сил к ядру притягивается n ионов противоположного знака – противоионов, компенсирующих заряд ядра. В данном случае эту роль выполняют ионы K + . Часть противоионов (2n - x), наиболее близко расположенных к ядру, находится в слое жидкости, смачивающем поверхность твердого ядра. Эти ионы испытывают действие не только электростатических, но и ван-дер-ваальсовых сил ядра, поэтому прочно удерживаются около него и образуют так называемый адсорбционный слой противоионов. Ядро с адсорбционным слоем противоионов образует коллоидную частицу. Остальные x противоионов, слабее, связанных с ядром (только электростатически), под влиянием теплового движения располагаются в жидкой фазе диффузно (размыто), почему и носят название диффузного слоя. Все это образование вместе и является мицеллой. 78 Электрофорез — направленное перемещение частиц дисперсной фазы под действием приложенной разности потенциалов.[14] Это явление наблюдается в седиментационно устойчивых дисперсных системах. При наложении на такую систему внешней разности потенциалов происходит разрыв ДЭС по плоскости скольжения, в результате чего частица получает заряд и перемещается к соответствующему электроду (рис.2.1).[6] Принцип метода заключается в следующем. Коллоидный раствор помещают в U-образную трубку, сверху наливают слабый раствор некоагулирующего электролита, так называемую боковую жидкость, и наблюдают за перемещением границы раздела золь – боковая жидкость. В одном колене трубки граница раздела поднимается, т.к. коллоидные частицы переходят в боковую жидкость, а в другом – опускается, поскольку коллоидные частицы перемещаются в межмицеллярную жидкость и движутся вглубь коллоидного раствора. Боковая жидкость необходима для создания четкой границы раздела (рис.2.2). В отличие от коллоидного раствора она должна быть прозрачной и бесцветной. Кроме того, она не должна содержать коагулирующих ионов и не должна влиять на ζ – потенциал переходящих в нее из золя коллоидных частиц. Помимо этого, боковая жидкость должна обладать электропроводностью равной или немного большей электропроводности коллоидной системы. Наилучшей боковой жидкостью является дисперсионная среда исследуемой коллоидной системы. Электрофорез наблюдают в U-образном сосуде (рис.2.2). В нижнюю часть сосуда наливают золь, сверху — контактную (боковую) жидкость, имеющую одинаковую (или немного большую) с золем электрическую проводимость. Наблюдают за изменением уровня золя в обоих коленах трубки и по скорости перемещения частиц дисперсной фазы определяют линейную скорость электрофореза. Рисунок 2.2 – Схема процесса электрофореза коллоидного раствора Таким образом, к катоду (отрицательно заряженному электроду) устремится коллоидная частица золя, имеющая положительный заряд, а к аноду (положительно заряженному электроду) устремятся противоионы хлора. 2. Свойства коллоидных систем Современная теория устойчивости и коагуляции коллоидных систем была разработана Б. В. Дерягиным и Л. Д. Ландау. В основе этой теории лежат представления о силах молекулярного притяжения, с одной стороны, и силах электростатического отталкивания, с другой. Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время. Устойчивость дисперсных систем может быть: - седиментационная (кинетическая) - это устойчивость к осаждению дисперсной фазы - характеризует способность дисперсной системы сохранять






- Различие между двумя изомерными комплексными солями кольбата, имеющими одинаковую формулу CoBr(SO4)5NH3, состоит в том, что раствор одной соли образует осадок с BaCl2, но не образует осадка с AgNO3, раствор же другой соли обладает противоположными свойствами. Как называется этот вид изометрии? Составьте координационные формулы исходных соединений, назовите их. Возможна ли для этих комплексов цис-транс изомерия?
- Напишите термохимическое уравнение реакции между оксидом углерода (II) и водородом, в результате которой образуются метан и пары воды. Сколько теплоты выделится при этой реакции?
- Истинная теплоемкость свинца может быть рассчитана по урав- мнению C = 0,1233 + 5, 682-10 Дж/(моль К) Температура плавления свинца 326 °С. Какое количество теплоты необходимо подвести, чтобы расплавить 1 кг металла, взятого при 17 °С? Ярь = 25 Дж/кг.
- При учете векселя за 40 дней до срока его погашения по простой учетной ставке 14% годовых банк выплатил его предъявителю 5000 руб. Каков доход банка от этой операции, если К = 360.
- Черентаев и Саунин, будучи в нетрезвом состоянии, поздно вечером остановили на улице Власова и, угрожая обрезом, потребовали закурить.
- Клиент положил на депозит 200 тыс. руб. на девять месяцев под простую процентную ставку 5% годовых. Определить реальную сумму, которую получит через девять месяцев клиент, если месячный темп инфляции составлял 1 %.
- Определите показатели эффективности оборотных средств ( число оборотов оборотных средств, длительность одного оборота)
- Вычислить стандартную теплоту образования соединения из простых веществ, если известна его теплота сгорания (табл. 3) при Т = 298 К и давлении 101 330 Па.
- Просторов решил забраться в квартиру к Дудкину в его отсутствие с целью совершения кражи. Выбрав время, когда Дудкин отсутствовал дома, Просторов подобрав ключи проник к нему в квартиру.
- Дано: Т = 293 К С = 1·10-4 моль/л NaCl CaCl2 MgSO4 T1 = 273 K T2 = 323 K ε1 = 87.8 ε2 = 69.7
- Ссудаа 250 тыс. руб. выдана на семнадцать месяцев по номинальной ставке 12% годовых. Начисление процентов производится по полугодиям. Определите наращенную сумму при её вычислении смешанным способом.
- Для несения службы на территории Адмиралтейского района 22 января 2018 года задействовались сотрудники ОР ППСП, ОГИБДД, вневедомственной охраны, участковые уполномоченные полиции, курсанты Санкт-Петербургского университета МВД России и военнослужащие СМВЧ 5402. Задание: Определите к каким силам охраны общественного порядка относятся описанные силы.
- Дайте характеристику атомно-абсорбционного анализа.
- Задача 4. Годовая норма амортизации 24%; первоначальная стоимость основных производственных фондов (ОПФ) 162 тыс. руб., остаточная стоимость 131 тыс. руб.
