
Дана молекула РН3 (см. ваш вариант в табл. 2). (Решение → 34490)
Заказ №38812
Дана молекула РН3 (см. ваш вариант в табл. 2). 1. Покажите образование связи в молекуле. Является ли она парамагнитной? 2. Используя аналоги электронной структуры элемента с большей вероятностью в молекуле запишите ряд однотипных молекул и дайте сравнительный анализ их структуры и свойств (валентный угол, энергия и длина связей, полярность молекул).
Решение:
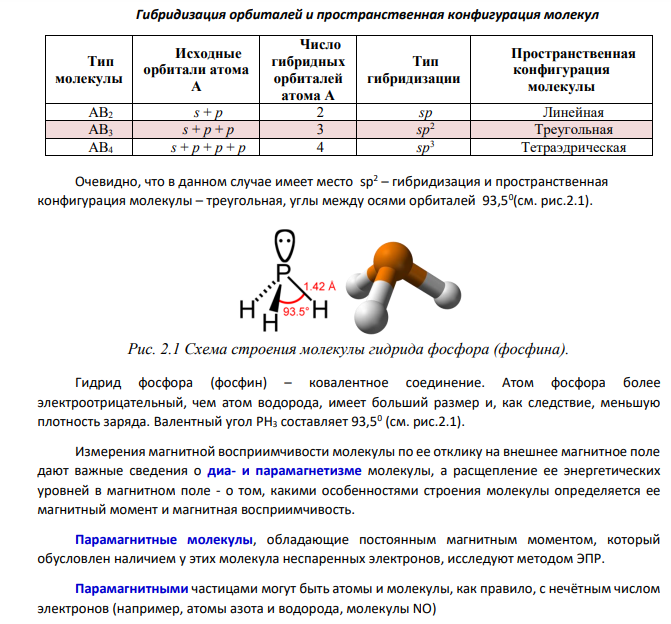
При наличии у пары электронов противоположных спинов электроны двигаются в поле обоих ядер. Между ядрами появляется область с высокой плотностью электронного облака – избыточного отрицательного заряда, который стягивает положительно заряженные ядра. Из квантово-механического расчета следуют положения, являющиеся основой метода ВС: 1. Причиной связи является электростатическое взаимодействие ядер и электронов. 2. Связь образуется электронной парой с антипараллельными спинами. 3. Насыщаемость связи обусловлена образованием электронных пар. 4. Прочность связи пропорциональна степени перекрывания электронных облаков. 5. Направленность связи обусловлена перекрыванием электронных облаков в области максимальной электронной плотности. Очевидно, что число ковалентных связей не может превышать числа образующих связи электронных пар. Однако насыщаемость как свойство ковалентной связи означает также, что если атом имеет некоторое количество неспаренных электронов, то все они должны участвовать в образовании ковалентных связей. Это свойство объясняется принципом наименьшей энергии. При образовании каждой дополнительной связи выделяется дополнительная энергия. Поэтому все валентные возможности реализуются полностью. Для фосфора 3s 2 3p 3 Для водорода 1s 1 МВС достаточно хорошо, предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее обстоятельство связано с так называемой гибридизацией АО. Она была введена для объяснения того факта, что двухэлектронные двухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, в данной случае Р (3s 23p 3 ) и H(1s 1 ), образуют за счет s- и p-орбиталей соответственно три связи. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей (q) равно числу исходных. 178 179 Гибридизация орбиталей и пространственная конфигурация молекул Тип молекулы Исходные орбитали атома А Число гибридных орбиталей атома А Тип гибридизации Пространственная конфигурация молекулы АВ2 s + p 2 sp Линейная АВ3 s + p + p 3 sp2 Треугольная АВ4 s + p + p + p 4 sp3 Тетраэдрическая Очевидно, что в данном случае имеет место sp2 – гибридизация и пространственная конфигурация молекулы – треугольная, углы между осями орбиталей 93,50 (см. рис.2.1). Рис. 2.1 Схема строения молекулы гидрида фосфора (фосфина). Гидрид фосфора (фосфин) – ковалентное соединение. Атом фосфора более электроотрицательный, чем атом водорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол РН3 составляет 93,50 (см. рис.2.1). Измерения магнитной восприимчивости молекулы по ее отклику на внешнее магнитное поле дают важные сведения о диа- и парамагнетизме молекулы, а расщепление ее энергетических уровней в магнитном поле - о том, какими особенностями строения молекулы определяется ее магнитный момент и магнитная восприимчивость. Парамагнитные молекулы, обладающие постоянным магнитным моментом, который обусловлен наличием у этих молекула неспаренных электронов, исследуют методом ЭПР. Парамагнитными частицами могут быть атомы и молекулы, как правило, с нечётным числом электронов (например, атомы азота и водорода, молекулы NO)



- Каков знак изменения энтропии в процессе кипения воды?
- Дать оценку эффективности инвестиционного проекта, в котором первоначальные затраты предприятия составляют 580 тыс. руб., а ожидаемые поступления денежной наличности по годам: 1 год – 90 000 руб. 2 год – 210 000 руб. 3 год – 320 000 руб. 4 год – 320 000 руб. Ставка дисконтирования равна 20 %.
- Завдання 6
- На основе данных таблицы 1: 1. Рассчитайте цену продажи стандартного номера при условии, что точка безубыточности гостиницы достигается при коммерческой загрузке номеров в 80%. 2. Определите продажные цены на все категории номеров в гостинице, исходя из следующей планируемой разницы в цене: номер «студия» - надбавка 50%, номер «люкс» - надбавка 100%, номер апартамент – надбавка 200%.
- Почему нейтрон, находясь в ядре, обладает отрицательной потенциальной энергией?
- Вычислите равновесные концентрации водорода и йода в реакции Н2 + I2 = 2HI. если их начальные концентрации составляли по 0,03 моль л, а равновесная концентрация йодоводорода [HI] = 0,04 моль/л Вычислите константу химического равновесия.
- На основе исходных данных определить следующие экономические показатели: 1) Издержки производства (цеховая себестоимость) 2) Полная себестоимость изделия
- Що таке ступінь окиснення?
- Почему при изменении давления смещается равновесие системы 2SO2(г) + O2(г) = 2SO3(г) и не смешается равновесие системы N2(г) + О2(г) — 2NO(г)? Напишите выражение для константы равновесия каждой из данных систем.
- Для уравнений реакций, приведенных в таблице 3 и считающихся сложными, и уравнений реакций, приведенных в таблице 5 и считающихся простыми, написать кинетические уравнения скоростей прямых реакций. Таблица 3
- Вычислите AG т.р для реакции: 2FeO + SiO2 (а-кварц) -> 2FeO-SiO2 при температуре 1100 К.
- Что такое термодинамика и какие явления она изучает? Дайте определение и приведите примеры термодинамических процессов: изотермического, изобарического, изохорического и адиабатического.
- Дана функция спроса в виде QD = 240 – 9P и функция предложения QS = 47 + 70Р. Определить ситуацию при цене 4. 2. Определить равновесный объем и равновесную цену. 3. Дотация производителю – 2 руб. на ед. продукции.
- В результате аварийного выхода из строя очистных сооружений на предприятии был совершен залповый выброс вредных веществ в атмосферу.
