
Для уравнений реакций, приведенных в таблице 3 и считающихся сложными, и уравнений реакций, приведенных в таблице 5 и считающихся простыми, написать кинетические уравнения скоростей прямых реакций. Таблица 3 (Решение → 34485)
Заказ №38828
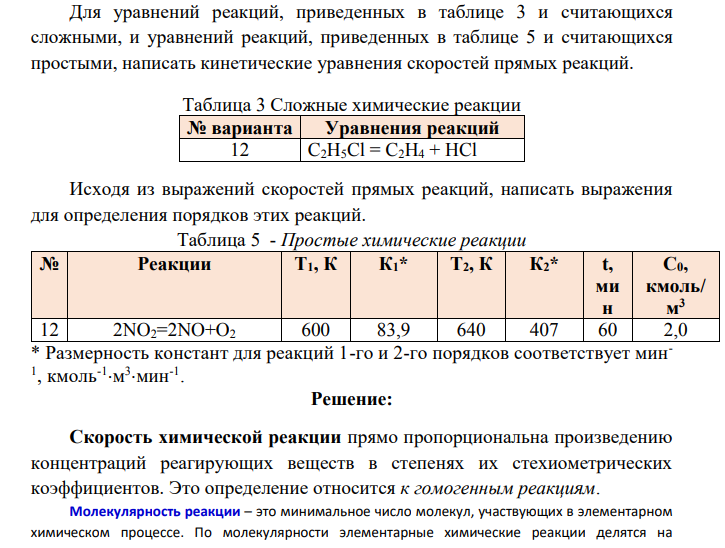
Для уравнений реакций, приведенных в таблице 3 и считающихся сложными, и уравнений реакций, приведенных в таблице 5 и считающихся простыми, написать кинетические уравнения скоростей прямых реакций. Таблица 3 Сложные химические реакции № варианта Уравнения реакций 12 C2H5Cl = C2H4 + HCl Исходя из выражений скоростей прямых реакций, написать выражения для определения порядков этих реакций. Таблица 5 - Простые химические реакции № Реакции Т1, К К1* Т2, К К2* t, ми н С0, кмоль/ м 3 12 2NO2=2NO+O2 600 83,9 640 407 60 2,0 * Размерность констант для реакций 1-го и 2-го порядков соответствует мин1 , кмоль-1 м 3 мин-1 .
Решение:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. Это определение относится к гомогенным реакциям. Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко. В данном случае обе реакции являются молекулярными. Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции. .1 Для реакции 2NO2=2NO+O2 скорость прямой реакции 𝜗1 = 𝑘1 ∗ 𝐶 2 (𝑁𝑂2) которая считается простой, порядок реакции определяем по формуле 2 υ = kC или dC 2 = kC . dt 247 Решим дифференциальное уравнение относительно С: 2 dC = kdt, C 2 dC kdt + const, C 1 =kt +const. C Найдём константу интегрирования, учитывая, что при t = 0, C = C0, получится 0 1 k 0 const. С Тогда окончательный результат: 0 1 1 = +kt. C C Подставляя в это уравнение численные значения k, t и С0, можно определить С -



- Вычислите AG т.р для реакции: 2FeO + SiO2 (а-кварц) -> 2FeO-SiO2 при температуре 1100 К.
- Что такое термодинамика и какие явления она изучает? Дайте определение и приведите примеры термодинамических процессов: изотермического, изобарического, изохорического и адиабатического.
- Дана функция спроса в виде QD = 240 – 9P и функция предложения QS = 47 + 70Р. Определить ситуацию при цене 4. 2. Определить равновесный объем и равновесную цену. 3. Дотация производителю – 2 руб. на ед. продукции.
- В результате аварийного выхода из строя очистных сооружений на предприятии был совершен залповый выброс вредных веществ в атмосферу.
- Дана молекула РН3 (см. ваш вариант в табл. 2).
- Каков знак изменения энтропии в процессе кипения воды?
- Дать оценку эффективности инвестиционного проекта, в котором первоначальные затраты предприятия составляют 580 тыс. руб., а ожидаемые поступления денежной наличности по годам: 1 год – 90 000 руб. 2 год – 210 000 руб. 3 год – 320 000 руб. 4 год – 320 000 руб. Ставка дисконтирования равна 20 %.
- Вычислите изменение энтропии при нагревании 1 моль ү-тридимита от 25 д 100 °С.
- Сбережения в экономике заданы формулой S = 0,04Y2 – 3, где Y – доход. Найти предельную склонность к потреблению при доходе равном 8 тыс. ден. ед.
- Планируемые капитальные вложения в обновление оборудования в 2015 году составляют 80 млн.руб. Новое оборудование с 2016 года обеспечит рост производства на 30% за счет более высокой производительности и сокращения времени простоя, а также снизятся эксплуатационные расходы на 20%, т.к. увеличится межремонтный период, сократится число обслуживающего персонала, снизятся энергозатраты
- Две реакции одинакового порядка имеют энергии активации 80 и 120 кДж/моль. Рассчитайте соотношение предэкспоненциальных множителей реакций, если соотношение их скоростей при 300° С равно 4?
- Завдання 7
- Що таке ступінь окиснення?
- Почему при изменении давления смещается равновесие системы 2SO2(г) + O2(г) = 2SO3(г) и не смешается равновесие системы N2(г) + О2(г) — 2NO(г)? Напишите выражение для константы равновесия каждой из данных систем.
