
Приведите схему разделения смеси, содержащей катионы аммония, стронция, железа (II), марганца. (Решение → 34654)
Заказ №38812
Приведите схему разделения смеси, содержащей катионы аммония, стронция, железа (II), марганца.
Решение:
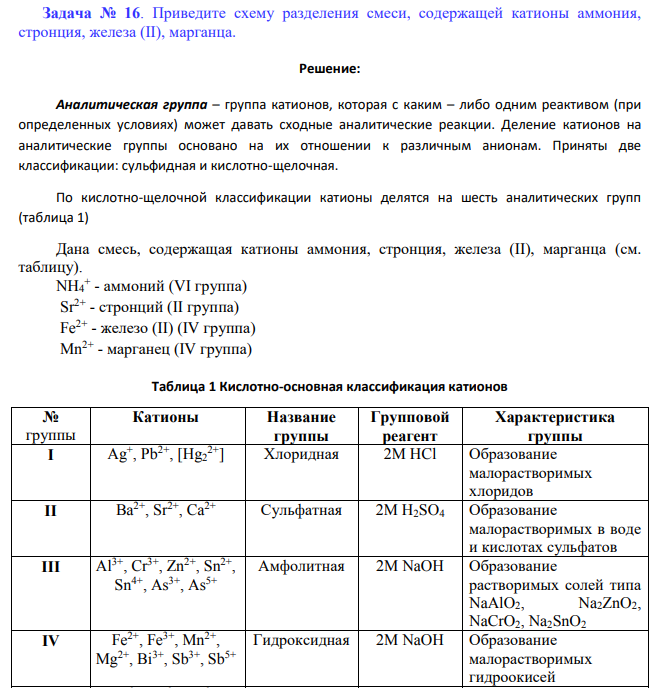
Аналитическая группа – группа катионов, которая с каким – либо одним реактивом (при определенных условиях) может давать сходные аналитические реакции. Деление катионов на аналитические группы основано на их отношении к различным анионам. Приняты две классификации: сульфидная и кислотно-щелочная. По кислотно-щелочной классификации катионы делятся на шесть аналитических групп (таблица 1) Дана смесь, содержащая катионы аммония, стронция, железа (II), марганца (см. таблицу). NH4 + - аммоний (VI группа) Sr2+ - стронций (II группа) Fe2+ - железо (II) (IV группа) Mn2+ - марганец (IV группа) Таблица 1 Кислотно-основная классификация катионов № группы Катионы Название группы Групповой реагент Характеристика группы I Ag+ , Pb2+, [Hg2 2+] Хлоридная 2M HCl Образование малорастворимых хлоридов II Ba2+, Sr2+, Ca2+ Сульфатная 2M H2SO4 Образование малорастворимых в воде и кислотах сульфатов III Al3+, Cr3+ , Zn2+, Sn2+ , Sn4+, As3+, As5+ Амфолитная 2M NaOH Образование растворимых солей типа NaAlO2, Na2ZnO2, NaCrO2, Na2SnO2 IV Fe2+, Fe3+, Mn2+ , Mg2+, Bi3+, Sb3+, Sb5+ Гидроксидная 2M NaOH Образование малорастворимых гидроокисей V Cu2+, Cd2+, Co2+ , Ni2+, Hg2+ Аммиакатная 2M NH4OH (избыток) Образование растворимых комплексов – аммиакатов VI K + , Na+ , NH4 + Растворимая Нет группового реагента Хлориды, сульфаты, гидроксиды растворимы в воде 159 Анализ смеси катионов I-VI аналитических групп, основанный на кислотно-основной классификации, начинают обычно с обнаружения иона аммония дробным методом. Проба на катионы в растворе. Большинство аналитических реакций недостаточно специфично и дает сходный эффект с несколькими ионами. Поэтому в процессе анализа приходится прибегать к отделению ионов друг от друга. Таким образом, открытие ионов проводится в определенной последовательности. Последовательное разделение ионов и их открытие носит название систематического хода анализа. Систематический ход анализа основан на том, что сначала с помощью групповых реактивов разделяют смесь ионов на группы и подгруппы, а затем уже в пределах этих подгрупп обнаруживают каждый ион характерными реакциями. Групповыми реагентами действуют на смесь ионов последовательно и в строго определенном порядке. В ряде случаев прибегают не к систематическому разделению ионов, а к дробному методу анализа. Этот метод основан на открытии ионов специфическими реакциями, проводимыми в отдельных порциях исследуемого раствора. Так, например, ион Fe 2+ можно открыть при помощи реактива Кз[Fе(СN)6] в присутствии любых ионов. Так как специфических реакций немного, то в ряде случаев мешающее влияние посторонних ионов устраняют маскирующими средствами. Например, ион Zn2+ можно открыть в присутствии Fe2+ при помощи реактива (NH4)2[Hg(SCN)4], связывая мешающие ионы Fe2+ гидротартратом натрия в бесцветный комплекс. Дробный анализ имеет ряд преимуществ перед систематическим ходом анализа: возможность обнаруживать ионы в отдельных порциях в любой последовательности, а также экономия времени и реактивов. Но так как специфических реакций немного и мешающее влияние многих ионов нельзя устранить маскирующими средствами, в случае присутствия в растворе многих катионов из разных групп прибегают к систематическому ходу анализа, открывая лишь некоторые ионы дробным методом. После разделения катионов на группы с помощью групповых реагентов проводят обнаружение ионов внутри каждой группы. Предварительные испытания 1. Наблюдение окраски раствора на заключение о вероятном присутствии или отсутствии в нем окрашенных катионов. 2. Определение рН раствора. Каплю анализируемого раствора помещают на универсальную индикаторную бумагу и сравнивают окраску с цветной шкалой рН. Катионы IV группы Групповой реактив – 2М раствор щелочи КОН, NaOH – осаждает катионы IV группы Fe2+ , Fe3+ , Mn2+ , Bi3+ , Mg2+ , Sb (III), Sb(V) в виде гидроксидов Fe(OH)2 грязно-зеленого цвета, Fe(OH)3 краснобурого цвета, Mn(OH)2, Bi(OH)3, Mg(OH)2, Sb(OH)3, SbO(OH)3 белого цвета: Fe2+ + 2OH–→ Fe(OH)2↓, 160 Fe3+ + 3OH– → Fe(OH)3↓, Mn2+ + 2OH– → Mn(OH)2↓, Bi3+ + 3OH– → Bi(OH)3↓, Mg2+ + 2OH– → Mg(OH) ↓2, SbCl6 3– +3OH– → Sb(OH)3↓ + 6Cl– , SbCl6 – + 5OH– → SbO(OH)3↓ + H2O + 6Cl– . Осадки Fe(OH)2 и Мn(ОН)2 постепенно окисляются кислородом воздуха и изменяют свою окраску: Fe(OH)2 + О2 + 2Н2О → Fe(OH)3↓, красно-бурый 2Mn(OH)2 + O2 → 2МnО(ОН)2↓. черно-бурый При действии на катионы Fe2+ , Mn2+ и Sb (III) раствора щелочи в присутствии окислителей (Н2О2, Вr2 и др.) сразу выпадают осадки Fe(OH)3, MnO(OH)2 и SbO(OH)3: 2Fe2+ + 4ОН– + Н2О2 → 2Fe(OH)3↓, Мn 2+ + 2ОН– + Н2О2 → МnО(ОН)2↓ + Н2О, SbCl6 3– + 3OH– + H2O2 → SbO(OH)3↓ + 6Сl – + Н2О. Гидроксиды катионов IV группы растворяются в разбавленных сильных кислотах, но не растворяются в избытке щелочи и в растворе аммиака: Fe(OH)2 + 2H+ → Fe2+ + 2H2O, Fe(OH)3 + 3H+ → Fe3+ + 3H2O, Mn(OH)2 + 2H+ → Mn2+ + 2H2O, Bi(OH)3 + 3H+ → Bi3+ + 3H2O, Mg(OH)2 + 2H+ → Mg2+ + 2H2O, Sb(OH)3 + 3H+ + 6Cl– → SbCl6 3– + 3H2O, SbO(OH)3 + 5H+ + 6Сl – → SbCl– + 4H2O. Для растворения осадка МnО(ОН)2 помимо кислоты необходимо присутствие восстановителя (Н2О2, NaNO2): МnО(ОН)2 + 2Н++ Н2О2 → Mn2+ + O2 + ЗН2О. Осадок Мn(ОН)2 можно растворить в достаточно концентрированном растворе НС1 при нагревании. Восстановителем в данной реакции является Сl – -ион: МnО(ОН)2 + 4Н++ 2Сl – → Mn2+ + C12 + 3H2O. 161 Осаждение гидроксидов Mg(OH)2, Fe(OH)2, Mn(OH)2 растворами аммиака и щелочей неполное вследствие достаточно большой их растворимости. В присутствии солей аммония эти гидроксиды не осаждаются. Они растворяются в насыщенном растворе NH4C1. Например: Fe(OH)2 + 2NH4C1 → FeCl2 + 2NH4OH, Частные аналитические реакции ионов Fe2+ 1. Гексацианоферрат(III) калия K3[Fe(CN)6] с катионом Fe2+ образует синий осадок «турнбулевой сини»: 3FeSO4 + 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓+ 3K2SO4, 3Fe2+ + 2Fe(CN)6 3– → Fe3[Fe(CN)6]2↓. Осадок не растворяется в кислотах, но разлагается щелочами с образованием Fe(OH)2. При избытке реактива осадок приобретает зеленый оттенок. Реакции мешают ионы Fe3+, которые при большой концентрации дают с реактивом бурое окрашивание раствора, и ионы Мn 2+ и Bi3+, дающие с реактивом слабоокрашенные осадки, растворимые в кислотах. Выполнение реакций. В пробирку поместить 1–2 капли раствора FeSO4 и прибавить 1 каплю реактива. Полученный осадок разделить на две части, к первой прибавить 1-2 капли 2 М раствора НС1, ко второй– 1-2 капли 2 М раствора щелочи. Условия проведения реакции – с разбавленными растворами в кислой среде, рН = 3. 2. Окисление Fe2+ до Fe3+ . Ион Fe2+ представляет собой довольно сильный восстановитель и способен окисляться при действии ряда окислителей, например, H2O2, KMnO4, K2Cr2O7 в кислой среде и др. 2Fe2+ + 4OH– + H2O2 → 2Fe(OH)3↓. При проведении систематического анализа Fe2+ следует открыть в предварительных испытаниях (см. первую реакцию), т.к. в процессе разделения групп Fe2+ может окислиться до Fe3+ . Частные аналитические реакции ионов Mn2+ 1. Окисление висмутатом натрия NaBiO3, протекает по уравнению: 2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O. Реакция идет на холоду. Выполнение реакции: к 1-2 каплям раствора соли марганца прибавляют 3-4 капли 6 М раствора HNO3 и 5-6 капель H2O, после чего вносят лопаточкой немного порошка NaBiO3. перемешав содержимое пробирки, дают постоять 1-2 минуты, центрифугируют для отделения избытка висмутата натрия. В присутствии Mn2+ раствор становится фиолетовым в результате образования марганцевой кислоты, которая является одним из наиболее сильных окислителей.







- Общество с ограниченной ответственностью отгрузило в адрес акционерного общества сталь марки «Б». В сопроводительных документах ошибочно указано, что отгружена сталь марки «А», как это было предусмотрено в договоре между сторонами.
- При взаимодействии с водой 4,6 г сплава рубидия с некоторым другим щелочным металлом образуется 2,24 л водорода (н.у.). Какой щелочной металл был взят?
- Задача 8.Определить количество молей реагентов и продуктов реакции в состоянии равновесия по приведенному уравнению реакции.
- При кулонометрическом титровании 20,0 мл раствора дихромата калия электрохимически генерируемым железом (II) на восстановление ионов Сr2О7 2- понадобилось 25 мин при силе тока 200 мА. Определить нормальную концентрацию раствора К2Сr2О7.
- Условие задания. На основе квартальных данных об объемах продаж продукции предприятия (тыс. шт.) за 5 лет построена экономико-математическая модель. Оценки коэффициентов сезонности за последний год представлены в таблице. Таблица 7 - Коэффициенты сезонности Квартал
- Участник ОАО «Уралстрой» Рыбкин не смог присутствовать на общем собрании акционеров. На нем должен был обсуждаться вопрос о реорганизации общества в производственный кооператив. Тогда он выписал нотариальную доверенность, по которой передал свое право голоса своему другу Петрову - тоже акционеру общества.
- Не производя вычисления, дате мотивированный ответ, для каких из перечисленных ниже процессов изменение энтропии является положительной величиной.
- Задача 2 Определить тепловой эффект реакции, приведенной выше
- Фонд создается в течение 10 лет. Средства поступают в фонд в конце года равными суммами. На собранные средства в конце года начисляется 10% годовых.
- Пакет облигаций в количестве 800 шт., номиналом каждой облигации 10 000р. продается на фондовом рынке. До погашения облигаций остается три года.
- При прохождении тока последовательно через электролизёры, содержащие цианиды серебра и золота, в первом электролизёре на катоде выделилось 0,1079 г Ag, во втором – 0,0657 г Au. Вычислите: а) молярную массу эквивалента золота; б) его валентность в соединении, подвергнутом электролизу.
- Эндотермическая реакция взаимодействия метана с оксидом углерода (IV) протекает по уравнению СН4(г) + СО2(г) = 2СО(г) + 2Н2(г) ΔН 0 = + 247,37 кДж.
- Номинальная процентная ставка составляет 12% годовых при годовом темпе инфляции 4%. Чему равна годовая ставка с учетом инфляции? Чему равна эффективная реальная процентная ставка, если проценты начисляются ежемесячно? ежедневно? ежеквартально?
- Характеристика диаграммы состояния системы МgO-SiO2. Основные фазы системы (оксид магния, форстерид, экстатит, клиноэнстатит, протоэнстатит).
