
Приведите уравнения реакции гидролиза, рассчитайте константу гидролиза, степень гидролиза и рН 0,01 моль/л раствора аммония сульфата. (Решение → 34638)
Заказ №38812
Приведите уравнения реакции гидролиза, рассчитайте константу гидролиза, степень гидролиза и рН 0,01 моль/л раствора аммония сульфата. Дано: См=0,01 моль/л Найти: h, Кг, рН
Решение:
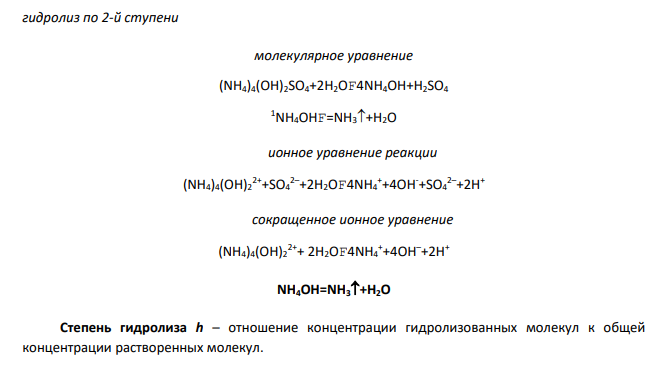
Гидролиз солей – взаимодействие ионов соли с водой с образованием слабого электролита. Сульфат аммония (NH4)2SO4 – соль, образованная слабым основанием (гидроксид аммония NH4OH)и сильной серной кислотой (H2SO4). гидролиз по 1-й ступени молекулярное уравнение 2(NH4)2SO4+2H2OF(NH4)4(OH)2SO4+H2SO4 ионное уравнение реакции 4NH4 –+2SO4 2–+2H2OF(NH4)4(OH)2 2++SO4 2–+2H++SO4 2– сокращенное ионное уравнение 4NH4 –+2H2OF(NH4)4(OH)2 2++2H+ гидролиз по 2-й ступени молекулярное уравнение (NH4)4(OH)2SO4+2H2OF4NH4OH+H2SO4 1NH4OHF=NH3+H2O ионное уравнение реакции (NH4)4(OH)2 2++SO4 2–+2H2OF4NH4 ++4OH-+SO4 2–+2H+ сокращенное ионное уравнение (NH4)4(OH)2 2++ 2H2OF4NH4 ++4OH–+2H+ NH4OH=NH3+H2O Степень гидролиза h – отношение концентрации гидролизованных молекул к общей концентрации растворенных молекул.


- Чему равен процентный платеж, если кредит 170 000 руб. взят на 7 месяцев под сложный годовой процент 17%.
- Согласно ФС «Потеря в массе при высушивании» натрия бензоата не должна превышать 2,0%. Соответствует ли анзлизируемый образец указанного вещества требованиям ФС по определяемому показателю, если масса пустого бюкса 5,38495 г, масса бикса с навеской вешества до высушикания- 15.88365 г.
- Объясните: - почему так значительно уменьшается температура плавления при переходе от углерода к кремнию, - какие изменения в структуре приводят к закономерному понижению температуры плавления простых веществ в ряду С - Рb;
- Диаграмы состояния системы Na2O-CaO-SiO2. Характеристика важнейших соединений, образующихся в этой системе.
- Определите, при какой температуре начинается реакция восстановления, протекающая по уравнению Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г) ΔН 0 = + 34,55 кДж.
- Рассчитайте, какая масса Ме(III) с электрохимическим эквивалентом 0,5430 г/моль выделится при электролизе в течение 1 мин 25 с, если сила тока равна 1,8 А.
- Найти срок ренты постнумерандо, если известны S = 2000, i = 15%, R = 100.
- Завдання 2 Запропонувати схему розділення та виявлення йонів, що містяться у розчині.
- Охарактеризуйте состав террористического акта (ст. 205 УК РФ)
- Сульфид олова(IV) растворим в сульфиде аммония, в щелочи и соляной кислоте. Написать уравнения реакций, объяснить, на какие свойства сульфида олова(I\/) указывают эти реакции.
- Сколько времени потребуется для электролиза 20 см3 0,2 М раствора CdSO4 при силе тока 0,1 А для полного выделения кадмия, если выход по току составляет 93%?
- Дайте аргументированный ответ, в каком из следующих случаев реакция не осуществима при любых температурах, а) ΔН 0 > 0, ΔS° > 0. б) ΔН 0 > 0, ΔS 0 < 0. в) ΔН 0 0.
- Какие из указанных металлов растворяются в разбавленной соляной кислоте: Pt, Zn, Cu, Ni, Sn? Напишите уравнения реакций и составьте электронные уравнения.
- Стоимость объекта лизинга (С) = 10000 тыс. руб., срок действия договора (Тл) — 5 лет, ставка лизингового процента (Пс) =15% годовых (в том числе 7% ставка по кредиту), выплата по лизингу ежеквартально (Т), выкуп объекта по остаточной стоимости (Со)= 3%.
