
В гальваническом цехе завода «Точприбор» происходит нанесение металлических покрытий металлом У на детали машин, сделанных из металла Х. Определить (используя приложение 6, табл.1.): 1.ЭДС концентрационного гальванического элемента, электродами которого являются металлы Х (столбец 2) и У (столбец 3) (электроды погружены в растворы своих солей), а концентрация растворимых солей Х и У составляют значения согласно варианту задания (столбец 6, 7). (Решение → 35583)
Заказ №38828
В гальваническом цехе завода «Точприбор» происходит нанесение металлических покрытий металлом У на детали машин, сделанных из металла Х.
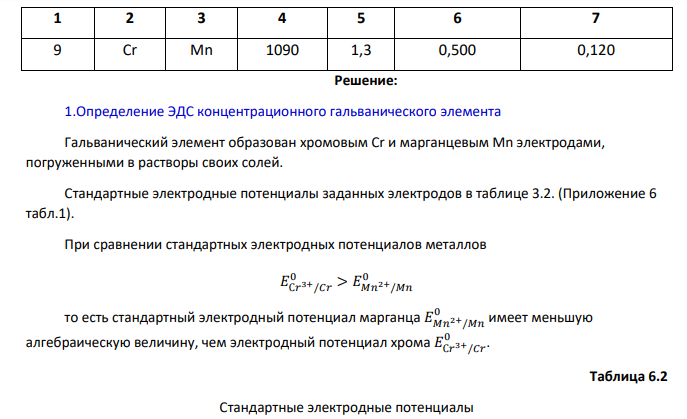
Определить (используя приложение 6, табл.1.): 1.ЭДС концентрационного гальванического элемента, электродами которого являются металлы Х (столбец 2) и У (столбец 3) (электроды погружены в растворы своих солей), а концентрация растворимых солей Х и У составляют значения согласно варианту задания (столбец 6, 7). 2.В процессе электролитического нанесения покрытия детали из металла Х, на её поверхности осаждается (m, г) металла У. Вычислить массу металла У, если электролитический процесс протекает при силе тока, равной I, А (столбец 5), в течение секунд (столбец 4). 3.Тип защитного покрытия. Таблица 6.1 Исходные данные № п/п металл Условия Х У , с I, А n X C , моль/л m Y C ,моль/л 21 1 2 3 4 5 6 7 9 Cr Mn 1090 1,3 0,500 0,120
Решение:
1.Определение ЭДС концентрационного гальванического элемента Гальванический элемент образован хромовым Cr и марганцевым Mn электродами, погруженными в растворы своих солей. Стандартные электродные потенциалы заданных электродов в таблице 3.2. (Приложение 6 табл.1). При сравнении стандартных электродных потенциалов металлов 𝐸С𝑟 3+/𝐶𝑟 0 > 𝐸𝑀𝑛2+/𝑀𝑛 0 то есть стандартный электродный потенциал марганца 𝐸𝑀𝑛2+/𝑀𝑛 0 имеет меньшую алгебраическую величину, чем электродный потенциал хрома 𝐸С𝑟 3+/𝐶𝑟 0 . Таблица 6.2 Стандартные электродные потенциалы Электрод Электродная реакция Е 0 , В Cr3+/Cr Cr3+ + 3e ⇄ Cr –0,744 Mn2+/Mn Mn2+ + 2e ⇄ Mn –1,180 Концентрация ионов хрома в растворе 𝐶С𝑟 3+ = 0,500 моль л , а ионов марганца 𝐶𝑀𝑛2+ = 0,120 моль л . По уравнению Нернста 𝐸 = 𝐸 0 + 𝑅 ∙ 𝑇 𝑛 ∙ 𝐹 ∙ 𝑙𝑛𝐶𝑀 = 𝐸 0 + 0,059 𝑛 ∙ 𝑙𝑔𝐶𝑀 где E 0 – стандартный электродный потенциал, В; R=8,314 кДж/(моль К) – универсальная газовая постоянная; Т – температура процесса, К; F=96500 - число Фарадея; n – число переходящих электронов. рассчитываем электродные потенциалы металлов 𝐸𝐶𝑟3+ 𝐶𝑟 = 𝐸𝐸𝐶𝑟3+ 𝐶𝑟 0 + 0,059 𝑛 ∙ 𝑙𝑔𝐶𝐶𝑟3+ = =−0,744 + 0,059 3 ∙ 𝑙𝑔0,500 = −0,750 𝐵 𝐸𝑀𝑛2+ 𝑀𝑛 = 𝐸𝑀𝑛2+ 𝑀𝑛 0 + 0,059 𝑛 ∙ 𝑙𝑔𝐶𝑀𝑛2+ =



- Для водного раствора электролита по Вашему варианту (табл. 11): 1) напишите уравнение процессов, которые идут на электродах при электролизе, укажите названия электродов и их заряд;
- 17-летний Крылов, который нигде не работал и испытывал острую нехватку материальных средств, в соответствие с заранее данным обещанием приятелю Ю. спрятал похищенный мотоцикл, за что получил от Ю. «на пропитание» 1000 рублей. По приговору Крылову был назначен штраф в размере 30 тыс.руб. Мог ли так поступить суд? Как бы вы поступили на месте судьи?
- Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: N2 → NH3 → (NH4)2SO4 → NH4Cl → NH3 → NH4NO3. б) Какие из приведенных оксидов растворяются в NaOH: MgO; Cr2O3; Na2O; CrO3; CaO; CO2? Напишите уравнения соответствующих реакций.
- Из бромэтана получить пропановую кислоту. Напишите уравнения следующих реакций: а) ацетилхлорид и ацетат натрия; б) диэтиловый эфир 2- бензил пропандиовой кислоты и разбавленная соляная кислота при кипячении; в) пропанамид и Р2O5 при нагревании; г) этилацетат и этилат натрия. Приведите механизм реакции "г".
- Особенности строения молекулы коллагена. Биороль коллагена.
- Стоимость приобретения основных средств – 2 800 000 руб., стоимость доставки до места назначения – 4000 руб., погрузочно-разгрузочные работы - 1200 руб. Монтаж и установка – 3050 руб.
- Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: P → P2O5 → H3PO4 → Na3PO4 → Ca3(PO4)2. б) Напишите уравнения реакций, которые доказывают амфотерный характер оксида хрома (III).
- Воспитанники детского дома Седов К. и Никитенко Л. Были признаны виновными в совершении преступления, предусмотренного п.п. «а, б, в» ч. 2 ст. 158 УК РФ. В приговоре суд указал: назначить наказание в виде штрафа в размере 5 тыс. рублей каждому, от назначенного наказания освободить и поместить в специальное учебно-воспитательное учреждение закрытого типа органа управления образованием на срок три года.
- Напишите строение трипептида Гли-Ала-Мет. Укажите пептидные связи N-С- концевые аминокислоты в молекуле;
- Для указанной в Вашем варианте пары металлов (табл. 12) определите, возможна ли коррозия в среде с указанным в таблице значением рН при контакте с влажным воздухом, для чего: 1) определите металл в паре, для которого более вероятна электрохимическая коррозия;
- а) Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Si → SiO2 → K2SiO3 → H2SiO3 → SiO2. б) С какими из указанных ниже веществ может взаимодействовать раствор KOH: HI; CuCl2; SO2; Ba(OH)2; PbO? Напишите уравнения соответствующих реакций.
- Исходя из положения германия цезия и технеция в периодической системе, составьте формулы следующих соединений мета- и ортогерманиевой кислот дигидрофосфата цезия и оксида технеция отвечающих их высшей степени окисления. Изобразите графические формулы этих соединений.
- Рассчитать базисные, цепные и средние показатели динамического ряда согласно варианту по журналу группы (исходные данные в таблицах 2 и 3), построить график, сделать выводы.
- Определить первоначальную и остаточную стоимость ОПФ предприятия, которое приобрело оборудование на сумму 18500 т. р., расходы по доставке оборудования составили 700т.р., расходы по монтажу – 180 т. р.; стоимость износа оборудования – 2200 т. р.
