
Запишите уравнение реакции вашего варианта (см. табл. 2) 1) Определите направление протекания реакции при этих температурах: а) из стандартного состояния; (Решение → 21703)
Заказ №39035
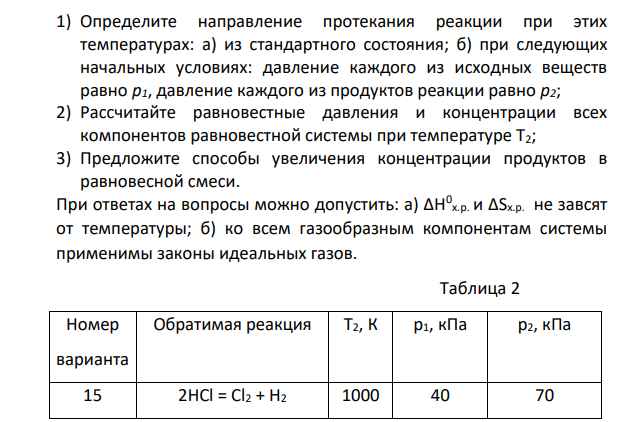
Запишите уравнение реакции вашего варианта (см. табл. 2) 1) Определите направление протекания реакции при этих температурах: а) из стандартного состояния; б) при следующих начальных условиях: давление каждого из исходных веществ равно р1, давление каждого из продуктов реакции равно р2; 2) Рассчитайте равновестные давления и концентрации всех компонентов равновестной системы при температуре Т2; 3) Предложите способы увеличения концентрации продуктов в равновесной смеси. При ответах на вопросы можно допустить: а) ∆Н0 х.р. и ∆Sх.р. не завсят от температуры; б) ко всем газообразным компонентам системы применимы законы идеальных газов. Таблица 2 Номер варианта Обратимая реакция Т2, К р1, кПа р2, кПа 15 2HCl = Cl2 + H2 1000 40 70
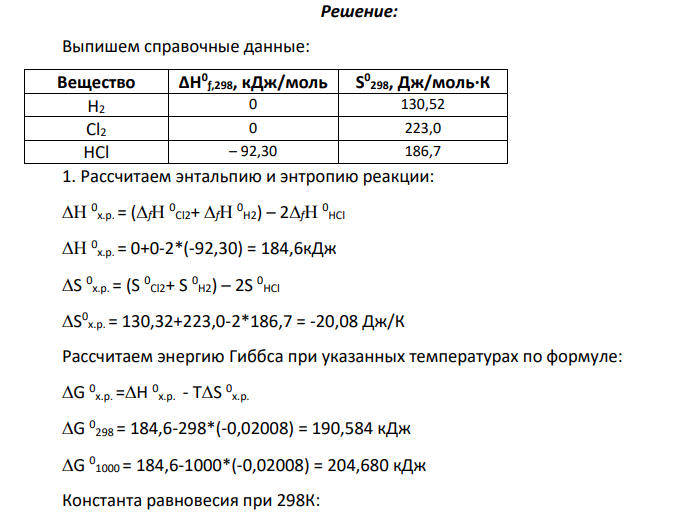
Решение: Выпишем справочные данные: Вещество ΔH 0 ƒ,298, кДж/моль S 0 298, Дж/моль∙К H2 0 130,52 Cl2 0 223,0 HCl – 92,30 186,7 1. Рассчитаем энтальпию и энтропию реакции: 0 х.р. = (f 0 Cl2+ f 0 H2) – 2f 0 HCl 0 х.р. = 0+0-2*(-92,30) = 184,6кДж S 0 х.р. = (S 0 Cl2+ S 0 H2) – 2S 0 HCl S 0 х.р. = 130,32+223,0-2*186,7 = -20,08 Дж/К Рассчитаем энергию Гиббса при указанных температурах по формуле: G 0 х.р. =Н 0 х.р. - ТS 0 х.р. G 0 298 = 184,6-298*(-0,02008) = 190,584 кДж G 0 1000 = 184,6-1000*(-0,02008) = 204,680 кДж Константа равновесия при 298К:
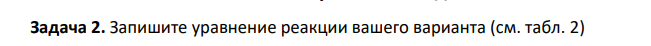

- Почему правило Вант-Гоффа называют эмпирическим? Какие ограничения существуют для этого правила
- 5. Запишите кинетические уравнения для реакций: 2NO + O2 = 2NO2; 2HI = H2 + I2; H2 (г) + S (к) = H2S (г).
- Имеются следующие данные о деятельности фирмы: AFC при 5-ти ед. выработки = 2000 у.д.е., AVC при 4-х ед. выработки = 850 у.д.е., ТС увеличиваются на 1240 у.д.е. при выработке 6-й ед. продукции; АТС при 5-ти ед. выработки = 2880 у.д.е.; произвести 1 единицу продукции стоит 1000 у.д.е. по сравнению с нулевым объемом производства; ТС при 8-ми ед. выработки = 19040 у.д.е.; TVC увеличиваются на 1535 у.д.е. при выработке 7-й ед. продукции; АТС падают на 5100 у.д.е. при возрастании выработки с 1-й до 2-й ед. На основании этих данных заполнить таблицу для выработки от 0 до 6- ти единиц продукции.
- Напишите уравнение электролитической диссоциации раствора слабой кислоты и найдите концентрации ионов Н+ и кислотного остатка в моль/л в растворе, если известны константа диссоциации Кдисс. И нормальность Сн Вариант Формула кислоты Название кислоты Сн,моль/л Кдисс 207 C6H4(OH)COOH Салициловая 1,0 1,1 10-3
- На рисунке показано направление линий магнитного поля. В этом магнитном поле перемещают замкнутый виток проволоки сначала вертикально вверх так, что плоскость витка параллельна линиям индукции магнитного поля (на рис. ситуация А), затем в горизонтальном направлении так, что плоскость витка перпендикулярна линиям индукции магнитного поля (на рис. ситуация Б).
- Для смазывания слизистой оболочки полости рта и горла применяют раствор Люголя, который содержит 1 г йода и 3 г йодида калия в 17 мл воды. Требуется приготовить 100 мл раствора Люголя из раствора с С(KI) – 4,65 моль/л и сухого йода. Плотность раствора Люголя принять равной 1,15 г/мл
- Судебное разбирательство проводится только в отношении обвиняемого и лишь по предъявленному ему обвинению.
- Задание 4 Какие вещества и в каких количествах выделятся при электролизе нитрата серебра при силе тока 2 А в течение 4 часов. Напишите уравнения электродных процессов.
- 4. Вращение колеса относительно неподвижной оси задано уравнением φ = 4t + 2t 3 , где φ - угол в радианах, t - время в секундах. Угловое ускорение колеса в момент времени t=1 сек равно...(рад/с2 ). 1. 12 2. 36 3. 18 4. 16 5. 24
- Изобразить кривую спроса при ситуации, если закупать зерно будет только государство и оно установит цену равную 10 000 руб. за тонну.
- Для реакции 2Co3+ + Tl+ = 2Co2+ + Tl3+ получена следующая зависимость скорости реакции от концентрации ионов в растворе:
- Вычислило pH а) 0,3н раствора хлорида алюминия (Кд=1,05*10-9 ). б) 0,3% раствора HCl (ρ=1,005 г/мл)
- В цепи резисторы R2=14 Ом, R3=6 Ом. ЭДС источника 11 В, внутреннее сопротивление источника 1 Ом. Показания амперметра 1 А.
- Согласно ст. 247 УПК РФ Судебное разбирательство уголовного дела проводится при обязательном участии подсудимого. При неявке подсудимого рассмотрение уголовного дела должно быть отложено. 284
