
Факторы, влияющие на величину удельной и эквивалентной электрической проводимости. Зависимость удельной и эквивалентной электрической проводимости для сильных и слабых электролитов от разведения. Объяснение особенностей этой зависимости. (Решение → 23152)
Заказ №38812
Факторы, влияющие на величину удельной и эквивалентной электрической проводимости. Зависимость удельной и эквивалентной электрической проводимости для сильных и слабых электролитов от разведения. Объяснение особенностей этой зависимости.
Решение:
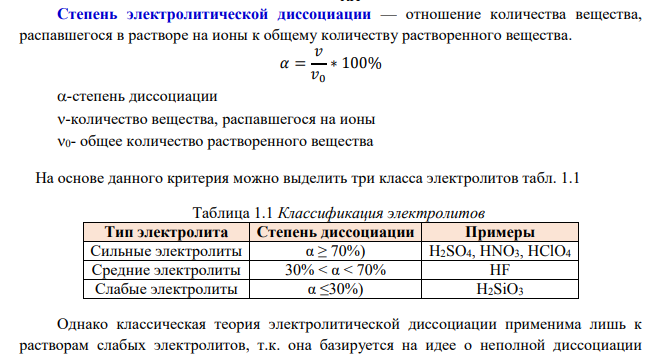
Электролит — вещество, расплав или раствор, который проводит электрический ток вследствие диссоциации на ионы (электролитическая диссоциация). Проводники бывают первого и второго рода. К проводникам первого рода относят проводники, обладающие электронной проводимостью (посредством движения электронов). К проводникам первого рода относят все металлы. К проводникам второго рода относят проводники с ионной проводимостью. Электролиты — проводники второго рода, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладают вследствие этого ионной проводимостью. Примерами электролитов могут служить кислоты, соли и основания. В растворах электролитов не все частицы диссоциируют на ионы. Количество частиц, продиссоциировавших на ионы в растворе электролита, характеризуется степень электролитической диссоциации. Классическая теория электролитической диссоциации базируется на идее о том, что не все частицы веществ диссоциируют, а лишь их часть. Отношение количества вещества, распавшегося в растворе на ионы, к общему количеству растворенного вещества характеризуется степенью диссоциации. Электролитическая диссоциация бинарного электролита KA КА = К++Агде КА-электролит; К + - катион; А - - анион Константа диссоциации KД определяется активностями (концентрациями) катионов, анионов и недиссоциированных молекул следующим образом: Кд = [К +][А −] КА Степень электролитической диссоциации — отношение количества вещества, распавшегося в растворе на ионы к общему количеству растворенного вещества. 𝛼 = 𝑣 𝑣0 ∗ 100% -степень диссоциации -количество вещества, распавшегося на ионы 0- общее количество растворенного вещества На основе данного критерия можно выделить три класса электролитов табл. 1.1 Таблица 1.1 Классификация электролитов Тип электролита Степень диссоциации Примеры Сильные электролиты α ≥ 70%) H2SO4, HNO3, HClO4 Средние электролиты 30% < α < 70% HF Слабые электролиты α ≤30%) H2SiO3 Однако классическая теория электролитической диссоциации применима лишь к растворам слабых электролитов, т.к. она базируется на идее о неполной диссоциации 878 веществ, а в таких веществах, которые относятся к сильным электролитам, диссоциация проходит практически полностью, и говорить в данном случае о степени диссоциации не имеет смысла. Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в воде или при плавлении. На процесс электрической диссоциации наряду с сольватирующей способностью частиц (сольватация - электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя) влияет также диэлектрическая проницаемость табл. 1.2. Чем больше диэлектрическая проницаемость, тем больше степень диссоциации Таблица 1.2. - Диэлектрическая проницаемость Относительная д.п.(ε) Абсолютная д.п.(εε0) Безразмерная величина, характеризующая свойства изолирующей (диэлектрической) среды. Данная величина показывает, во сколько раз взаимодействие между зарядами в однородной среде меньше, чем в вакууме. величина, показывающая зависимость электрической индукции i от напряжённости электрического поля. воздуха и большинства других газов в нормальных условиях большинство твёрдых или жидких веществ вода ε1 2ε8 ε≈80 Электропроводность электролитов - способность электролитов проводить электрический ток при приложении электрического напряжения. Носителями электрического тока в растворах электролитов служат ионы, образующиеся вследствие электролитической диссоциации. Катионы и анионы под действием внешнего электрического поля движутся в противоположных направлениях. Доля общего количества электричества, переносимого отдельными ионами, называется числами переноса, сумма которых для всех видов ионов, участвующих в переносе, равна единице. Количественно электропроводность электролитов характеризуют эквивалентной электропроводностью λ Электролитическая диссоциация является равновесным обратимым процессом и количественно характеризуется как степенью диссоциации, так и константой диссоциации (КД). Между степенью диссоциации слабого электролита 𝛼, его исходной концентрацией в растворе С0 и константой диссоциации КД существует зависимость, которая называется законом разведения Оствальда.




- Задание 3. Дан водный раствор электролита (см. вариант в табл. 14). 1. Укажите рН раствора электролита до электролиза (кислая, нейтральная, щелочная). 2. Запишите уравнения электродных реакций электролиза с графитовыми электродами
- Напишите электронные формулы атомов элементов с зарядом ядра: а) +46; б) +105; в) +114 и в) еще не открытого элемента с зарядом ядра +120.
- Задание 6. При определении марганца в сплаве методом сравнения навеску сплава массой 0,2 г растворили в смеси кислот и перенесли в мерную колбу на 500 мл
- .1.Между гражданином Ивановым и акционерным обществом был заключен договор, в соответствии с которым Иванову был предоставлен заем на срок 12 месяцев в сумме 500 тыс. рублей. Условия о размере уплачиваемых процентов за пользование денежными средствами между заемщиком и обществом согласованы не были.
- Ситуация 3. При аудите денежных средств установлено, что в учете отражены следующие хозяйственные операции. Субсчета к счетам синтетического учета соответствуют типовому плану счетов.
- На основе результатов, полученных в задании 30, и данных табл. 34 рассчитать параметры системы управления запасами с фиксированным размером заказа (порядок расчетов приведен в табл. 35). Нарисовать графическую модель работы системы управления запасами с фиксированным размером заказа:
- Вычислить ЭДС гальванического элемента Fe/ Fe 2+ // H2SO4 (0,1 М) / H2, Ag
- Какие из солей NaBr, Na2S. K2COj, C0CI2 подвергаются гидролизу? Составьте иомномолекуляриые и молекулярные уравнения гидролиза соответствующих cолеи
- Написать строение мицеллы золя, определить, к какому электроду будет двигаться коллоидная частица: FeS стабилизированный K2S
- Какая из следующих связей полярна? Укажите для каждой полярной связи более электроотрицательный атом и связи расположите в порядке возрастания степени их полярности: а) Cl-J; б) P-P; в) C-N; г)F-F; д) O-H
- Средня заработная плата на предприятии «С» составляет 20150 рублей. Руководство предприятия обещает ежегодное увеличение заработной платы всем сотрудникам на 9 %. Какой будет средняя заработная плата на предприятии «С» через 3 года, если планы менеджмента относительно роста заработной платы будут реализованы?
- Расчет экономической эффективности инвестиционного проекта При внедрении системы менеджмента качества в текущем году предприятие приняло решение внести изменения в технологию производства, направленные на повышение качества продукции Величина капитальных затрат на реализацию проекта в текущем году – 2,25 млн. руб.
- Определить оптимальный объем производства на основании приведенных исходных данных Таблица 1 – Исходные данные Показатели 1 участок продукты 2 участок продукты 1 2 3 4 5 6 7 Спрос, кг 29000 17000 26000 4000 8000 27000 35000
- Вы работаете финансовым аналитиком в компании «Собери мусор». Финансовый директор просит вас проанализировать проект. Предполагаемые инвестиции 10 тыс.дол. Денежные потоки имеют вид: 95 год 0 1 2 3 4 Проект Х -10000 6500 3000 -3000 1000 Какой метод оценки эффективности можно применить, а какой нельзя? Какие доп значения должны быть введены?
