
Какие законы роста защитных оксидных пленок на металлах Вам известны? Изобразить эти законы графически в координатах h = f(t). (Решение → 32898)
заказ №38755
Какие законы роста защитных оксидных пленок на металлах Вам известны? Изобразить эти законы графически в координатах h = f(t).
Решение:
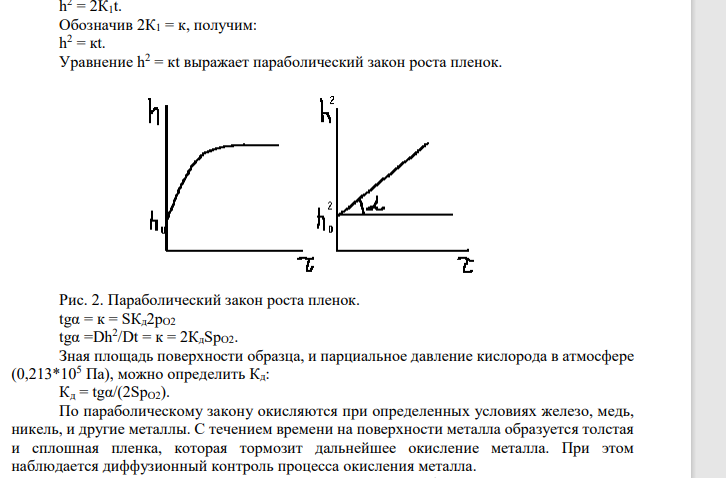
Для гетерогенных процессов, протекающих с образованием новой фазы продуктов реакции на поверхности металла, скоростью процесса можно считать рост толщины фазовой оксидной пленки h во времени t: v = dh/dt, см/с. Таким образом: dh/dt = кРО23 . Поскольку парциальное давление кислорода практически не изменяется, то можно принять: kР O2 3 = k1. При этом допущении скорость роста пленки будет постоянной: dh/dt = k1, то есть толщина пленки прямо пропорциональна времени испытаний. После интегрирования: h = k1t + const. При t = 0 константа интегрирования равна начальной толщине оксидной пленки: h0 = const Если принять h0 = 0, тогда: h = к1t (линейный закон роста пленок). Рис.1.Зависимость толщины пленки от времени образования при различных температурах (линейный закон). Линейный закон характерен для образования оксидных пленок на щелочных и щелочноземельных металлах на воздухе при низких температурах. Пленки в этом случае не обладают защитным действием, металлы разрушаются. По линейному закону могут окисляться и другие металлы (Мg, Al, Ni,Fe) при высоких температурах (900-10000С).В этом случае образуются толстые фазовые пленки, которые растрескиваются, отслаиваются от поверхности металла, вследствии возникновения внутренних механических напряжений в пленке. Условие несплошности толстых пленок: VМеО/VМе> 2,5. При высоких температурах (выше 10000С для таких металлов, как W, Nb, Мо, Та возможно окисление по линейному закону вследствии образования летучих оксидов. На основании вышесказанного можно записать условие сплошности фазовых пленок: 1 < VМеО/VМе < 2,5 Если фазовая пленка удовлетворяет условию сплошности, то диффузия реагентов через такую пленку затрудняется .Каков бы ни был механизм диффузии реагентов через пленку, здесь можно применить основные законы диффузии. Известно большое число уравнений для определения кинетических зависимостей процесса взаимодействия твердых и газообразных веществ при их диффузии через пленку продукта коррозии. Если предположить , что контролирующей стадией процесса окисления металла в атмосфере сухого воздуха является диффузия кислорода через пленку, то можно применить первый закон Фика: vд = Кд S(¶CO2/¶h), где vд скорость диффузии кислорода, Кд - константа скорости диффузии, л/(моль*с), S - площадь поверхности раздела фаз, см2 , h - толщина пленки продукта реакции, см CO2 - концентрация газообразного реагента, моль/л, ¶C/¶h - градиент концентрации газообразного реагента по направлению нормали к поверхности раздела фаз, моль/(л*см). Можно принять для данного образца, что площадь поверхности раздела фаз постоянна .Тогда скорость процесса, лимитируемую скоростью диффузии кислорода, можно выразить , заменив : vд = v и КдS = К'д. Тогда: v = К'д(CO2 – CO2 0 )/h, где СO2 - концентрация кислорода в атмосфере, то есть на внешней поверхности оксидной пленки, СO2 0 - концентрация кислорода на внутренней поверхности оксидной пленки, то есть вблизи поверхности металла. Для газообразного вещества концентрацию кислорода можно заменит парциальным давлением рO2 и принять рO2 0 = 0 ( если пленка сплошная и имеет плотную упаковку атомов в кристаллической решетке). Тогда скорость стационарной диффузии будет: v = Кд'рO21/h. Для обычных атмосферных условий парциальное давление кислорода постоянно, можно обозначить К'д*рО2 = К1 и записать: v = К11/h , После интегрирования: h 2 /2 = К1*t + h0 2 , h0 2 - константа интегрирование, принимаем ее равной нулю, тогда: h 2 = 2К1t. Обозначив 2К1 = к, получим: h 2 = кt. Уравнение h 2 = кt выражает параболический закон роста пленок. Рис. 2. Параболический закон роста пленок. tgα = к = SКд2рO2 tgα =Dh2 /Dt = к = 2КдSрO2. Зная площадь поверхности образца, и парциальное давление кислорода в атмосфере (0,213*105 Па), можно определить Кд: Кд = tgα/(2SрO2). По параболическому закону окисляются при определенных условиях железо, медь, никель, и другие металлы. С течением времени на поверхности металла образуется толстая и сплошная пленка, которая тормозит дальнейшее окисление металла. При этом наблюдается диффузионный контроль процесса окисления металла. В том случае, если в пленке имеются некоторые дефекты, дающие возможность кислороду диффундировать к поверхности оксидной пленки, то концентрация кислорода на внутренней поверхности пленки не равна нулю. Тогда можно наблюдать смешанный, диффузионно-кинетический контроль процесса окисления металла. Для установившегося процесса скорость химической реакции и скорость диффузии равны. Учитывая уравнения линейного и параболического законов роста пленок получаем сложно-параболический закон окисления металлов: h 2 /2К + h/к = сО2*t + const Для некоторых металлов (алюминий, кадмий, свинец) отношение объема оксида к объему металла примерно равно единице. На таких металлах образуются пленки, ориентированные относительно кристаллической решетки металла, то есть параметры кристаллической решетки металла и оксида примерно одинаковы. На металлах в этом случае образуются тонкие сплошные пленки, обладающие высокими защитными свойствами. В течении короткого отрезка времени такая пленка образуется и в дальнейшем ее толщина практически не увеличивается, происходит самоторможение процесса во времени, чему соответствует логарифмический закон роста пленки. h = кlg(аt + в), где к, а и в - постоянны





- Роль косвенных факторов в формировании химического состава природных вод.
- Определить экономность транспирации по следующим данным: интенсивность транспирации равна 25 г/(м2 ·ч), площадь поверхности листьев - 550 см2 , сырая масса растения - 20 г, абсолютно сухая масса - 9 г.
- План выпуска продукции на 2 квартал по выпечке булок круглых из муки пшеничной первого сорта рассчитан в размере 500т. Норма расхода условного топлива на 1 т готовой продукции – 120кг.
- В V см3 раствора с заданной молярной концентрацией вещества А растворено m г соли В. Рассчитайте рН полученного раствора.
- Чему равна индукция магнитного поля, если на прямолинейный участок длиной 20 см проводника с током 1,6 А действует максимальная сила Ампера 32 мкН? Изобразите, как сориентированы проводник с током и магнитное поле в этом случае.
- Проведите «ретро» синтетический анализ предложенных гетероциклических систем
- На основании величин окислительно-восстановительных потенциалов докажите возможность реакции K2Cr2O7+FeSO4+H2SO4 Составьте окислительно-восстановительное уравнение
- Спрос и предложение на некий товар описывается уравнениями: Qd=600-25*P, Qs=100+100*P, где Q - количество товара (в шт.), а Р – его цена (в руб.). Найдите параметры равновесия на рынке данного товара. Что произойдет, если максимально возможная цена (выше которой цену поднимать нельзя) будет установлена на уровне 5 рублей за единицу товара?
- Укажите, какие функциональные группы и ионы включены в данное лекарственное соединение.
- Определите потребное количество муки для выпуска хлеба пшеничного 2 сорта. Предусмотрен выпуск хлеба в объеме 1700т. Норма выхода продукции из муки пшеничной – 142%. Средний процент влажности поступающей муки – 15%. Норма возвратных отходов – 0,15% от потребного количества муки
- Fе3О4(т) + СО(г) ↔ Fе(т) + СО2(г); 7600 С Рассчитать изменение стандартной свободной энергии Гиббса и сделать вывод о направлении процесса при указанной температуре.
- Через рамку состоящую из 100 витков течет ток 2 А. Площадь рамки 2 50см . Чему равна величина магнитной индукции, если со стороны поля создается максимальный вращательный момент 4мН м ?
- Как объяснить различную величину дыхательного коэффициента прорастающих крахмалистых и маслянистых семян?
- Электролиз раствора сульфата некоторого металла проводили при силе тока 6А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла.
