
На основании величин стандартных электродных потенциалов по варианту 6 (табл. 10) составьте работающий в стандартных условиях гальванический элемент: 1) Приведите условную запись соответствующего гальванического элемента; (Решение → 35430)
Заказ №38834
На основании величин стандартных электродных потенциалов по варианту 6 (табл. 10) составьте работающий в стандартных условиях гальванический элемент: 1) Приведите условную запись соответствующего гальванического элемента; 2) запишите уравнения процессов на электродах в работающем гальваническом элементе, укажите название электродов и их заряд; 3) напишите уравнение токообразующей реакции; 4) вычислите стандартную электродвижущую силу Е 0 при 25°С; 5) определите стандартную энергию Гиббса ΔG° и вычислите константу равновесия Ка окислительно-восстановительной реакции, протекающей в гальваническом элементе; 6) запишите уравнение изотермы токообразующей реакции, рассчитайте изменение энергии Гиббса ΔG при указанных активностях ионов, сделайте вывод о возможности и направленности процесса в этих условиях.
Решение:
1. Гальваническими элементами называют устройства, в которых энергия окислительновосстановительных реакций преобразуется непосредственно в электрическую. Стандартные электродные потенциалы металлических электродов в водных растворах приведены в справочной литературе. Величины стандартных ЭП металлов (Е0 ) являются мерой восстановительной способности их атомов и мерой окислительной способности ионов металлов. Чем более отрицательное значение имеет потенциал системы Ме/Меn+, тем более сильной восстановительной способностью обладает атом. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. Е 0 (Fe3+, Fe2+| Pt)=0,771 В Е 0 (V3+ ,V2+| Pt)=-0,255 В В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой. Схемой заданного гальванического элемента явля ется запись: А(-)Pt |V 3+ ,V 2+ || Fe3+, Fe2+| Pt (+)К. Анод – электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. 2. Запишем электродные процессы: 91 (−) Анод: V 0 - 2 е V 2+ (окисление) │2|1 (+) Катод: Fe2++2 е Fe0 (восстановление) │2|1 V 0+Fe2+=V2++Fe0 или (−) Анод: V 0 - 3 е V 3+ (окисление) │3|1 (+) Катод: Fe3++3 е Fe0 (восстановление) │3|1 V 0+Fe3+=V3++Fe0

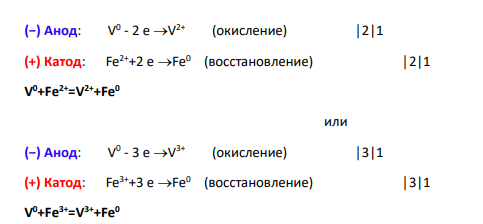

- Используя данные табл.3.2 выполнить аналитическую группировку с целью изучения зависимости между затратами туристических фирм на рекламу и числом туристов, воспользовавшихся их услугами, образовав по факторному признаку 5 групп.
- Селетов совместно с 13-летними Баяновым и Сергейниковым совершили в отношении малолетнего Н. насильственные действия сексуального характера. Суд квалифицировал действия Селетова по п. «а» ч.2 ст.132 УК, указав, что в них содержится квалифицирующий признак «группой лиц по предварительному сговору».
- Гражданин Абрамов обратился в территориальный орган федерального органа исполнительной власти с запросом о предоставлении общедоступной информации о деятельности данного территориального органа. В ответ гражданину было направлено уведомление об отсрочке ответа на запрос, в котором был указан только срок предоставления запрашиваемой информации.
- При проектировании цеха по производству химического вещества (Х) в промышленных масштабах необходимо указать расположение вентиляционных шахт для вывода людей из рабочей зоны, в которой возможно возникновение чрезвычайной ситуации. Задания (вещество Х определяется вариантом):
- Показатели готовой продукции предприятия, тыс. единиц.
- Что называется сродством к электрону? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера?
- Вычислите массу гидроксида натрия, если на его титрование было израсходовано 12,45 мл 0,1152 н. раствора азотной кислоты.
- Несовершеннолетняя Б., возвращаясь вечером с дискотеки домой, села в попутную машину, которой управлял Башаров. Башаров решил изнасиловать пассажирку. Он вывез ее за город в карьер, где, угрожая утопить в болоте, и нанеся несколько ударов по лицу, сломил сопротивление потерпевшей.
- Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Ca → Ca(OH)2 → CaCO3 → CaCl2 → Ca3(PO4)2. б) Составьте уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3; Ca(HCO3)2; MgOHCl
- Разложение аммиака. Кинетическое уравнение: U=(k, P)*((PNH3/PH,155 PN,*PH,15/(PNH,*Kp)) Зависимость константы скорости прямой реакции от температуры: K-=18.56*1015*exp(-142630 (8.31*T)) Зависимость константы равновесня от температуры: IgKp=-2078/T+ 2.4943-lg(T)+ 1. 256-10 +-T1. 8564-107 -T2 - 2.206. Исходный состав (мольные долп): аммнак 0.27, азот 0.01. водород 0.01. остальное - метан. н.
- Определите pH начала и конца скачка титрования без учета разбавления раствора при титровании 75,00 мл 0,1500 н. раствора гидроксида аммония 0,1500 н. раствором хлороводородной кислоты.
- Какова современная формулировка Периодического закона? Объясните, почему в Периодической системе элементов аргон, кобальт, теллур и торий помешены соответственно перед калием, никелем, йодом и протактинием, хотя и имеют большую атомную массу?
- Как изменится скорость прямой и обратной реакции в системе СО(г) + 3Н2(г) СН4(г) + H2O(г), если концентрации исходных веществ и продуктов реакции уменьшить в 2 раза? В каком направлении сместится равновесие?
- Получите изопрен из пентана, хлоропрен из ацетилена. Приведите реакции хлорирования
