
Приведите математическое выражение для скорости реакции, вычислите, во сколько раз изменится скорость при изменении следующих факторов C+2H2FCH4 а) снижение концентрации углерода в 4 раза. (Решение → 26327)
Заказ №38836
Приведите математическое выражение для скорости реакции, вычислите, во сколько раз изменится скорость при изменении следующих факторов C+2H2FCH4 а) снижение концентрации углерода в 4 раза.
Решение:
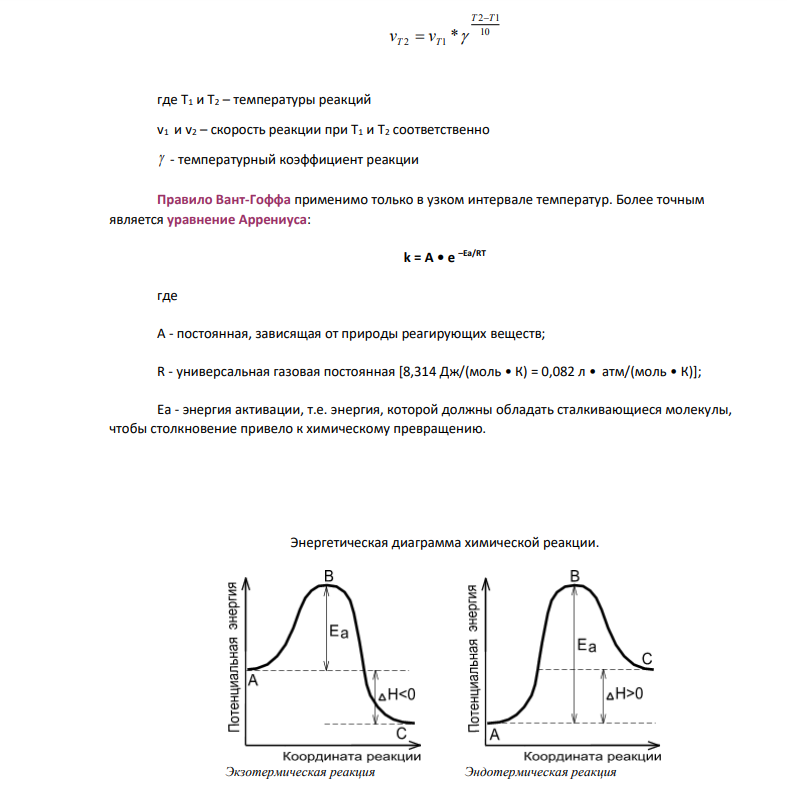
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V = С2 – С1t2 - t1= С / t) где С1 и С2 - молярные концентрации веществ в моменты времени t1 и t2 соответственно (знак (+) – если скорость определяется по продукту реакции, знак (–) – по исходному веществу). Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость определяется количеством столкновений и вероятностью того, что они приведут к превращению. Число столкновений определяется концентрациями реагирующих веществ, а вероятность реакции - энергией сталкивающихся молекул. Факторы, влияющие на скорость химических реакций. 1.Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно. 2.Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает. Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.) Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. aA + bB + . . . . . . V = k • [A]a • [B]b • . . . Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов. Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ. Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит. 2. Температура. При повышении температуры на каждые 10C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле: 10 2 1 2 1 * T T T T v v где Т1 и Т2 – температуры реакций v1 и v2 – скорость реакции при Т1 и Т2 соответственно - температурный коэффициент реакции Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса: k = A • e –Ea/RT где A - постоянная, зависящая от природы реагирующих веществ; R - универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л • атм/(моль • К)]; Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению. Энергетическая диаграмма химической реакции. Экзотермическая реакция Эндотермическая реакция



- Приведите электронные формулы и изобразите графически распределение электронов по орбиталям для следующих атомов и ионов: атом железа; суфид –иона
- Вычислите объем газа, образованного при нормальных условиях в результате взаимодействия: 100г карбоната калия и раствора, содержащего 100г серной кислоты.
- Составьте уравнения реакций в молекулярной и ионной форме, попарно протекающих между следующими соединениями: Zn(OH)2 , HNO3 ,Ca(OH)2 ,H2SO4
- Составьте уравнения реакций в молекулярной и ионной форме, соответствующие следующей последовательности превращений PP2O5Na3PO4Na2CO3NaCl
- Напишите уравнения реакции дегидратации пропилового спирта. Составьте схему полимеризации полученного углеводорода.
- Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода.
- Электролиз раствора Na2SO4 проводился в течение 5 часов при силе тока 7А. Составьте электронные уравнения процессов, происходящих на электродах.
- По данным таблицы 1 определите сдельную заработную плату за месяц. По внутризаводскому положению сдельные расценки за продукцию, 273 выработанную сверх нормы до 110%, повышаются в 1,2 раза, от 110 до 120% — в 1,4 раза
- Проведите имитационное моделирование. Минимум для 10 прогонов реализуйте алгоритм имитационного моделирования для ситуации изменения только постоянных затрат (в диапазоне от 9 до 13 тыс долларов в год).
- Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель: H2S+KMnO4+2SO4S+MnSO4+K2SO4+H2O
- Как могут быть построены сценарии для данного проекта? Какие параметры Вы зададите и на основании каких факторов, чтобы построить оптимистический и пессимистический сценарии?
- Определите цвет известных Вам индикаторов в водных растворах солей, указанных в задании. Приведите уравнения гидролиза в ионной и молекулярной форме для следующих солей: сульфида бария, хлорида аммония.
- Определите рН следующих водных растворов. Сантимолярного раствора соляной кислоты (степень диссоциации-91%)
- Вычислите недостающий вид концентрации (массовую долю, молярную и эквивалентную концентрацию) растворенного вещества в растворе, если указана концентрация и плотность раствора: Массовая доля карбоната натрия –15%, плотность раствора 1,1 г/мл
