
Для химической реакции, указанной в таблице 3, вычислить тепловой эффект (Н0 ), изменение энтропии (S 0 ), изменение энергии Гиббса (G0 ) и константу равновесия (K0 ) при температуре Т = 398 К. Определить направление химической реакции, протекающей в газовой среде, заданного состава. (Решение → 34501)
Заказ №38828
Для химической реакции, указанной в таблице 3, вычислить тепловой эффект (Н0 ), изменение энтропии (S 0 ), изменение энергии Гиббса (G0 ) и константу равновесия (K0 ) при температуре Т = 398 К. Определить направление химической реакции, протекающей в газовой среде, заданного состава. Парциальные давления компонентов газовой смеси приведены в таблице 4. Проанализировать полученные результаты и ответить на следующие вопросы: 1. Каких веществ - исходных или продуктов реакции - будет больше в равновесной смеси? 2. Что означают фразы: «равновесие сдвинуто в сторону исходных веществ» и «равновесие сдвинуто в сторону продуктов реакции»?
Таблица 4 – Парциальные давления компонентов газовой смеси. № варианта Состав исходной газовой смеси Парциальные давления компонентов смеси, атм А В С Д РА РВ РС РД 1 2 3 4 5 6 7 8 9 15 C2H4 HF C2H5F - 4,0 1,2 3,5 -
Решение:
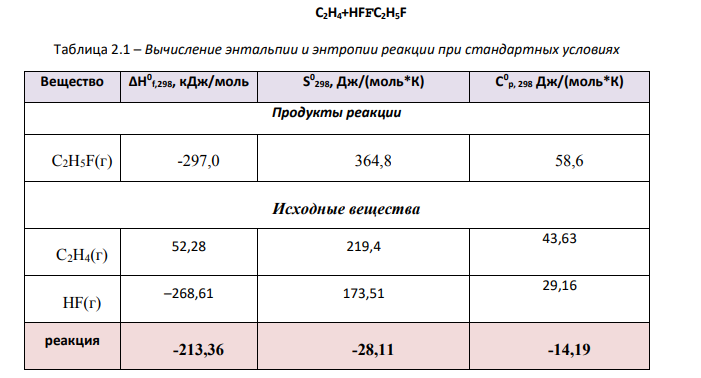
1. Вычислим тепловой эффект (Н 0 ), изменение энтропии (S 0 ), изменение энергии Гиббса (G 0 ) для заданной реакции для стандартных условий (Т=298, р=101,3кПа), используя следствия закона Гесса. C2H4+HFFC2H5F Таблица 2.1 – Вычисление энтальпии и энтропии реакции при стандартных условиях Вещество ΔН0 f,298, кДж/моль S 0 298, Дж/(моль*К) C 0 p, 298 Дж/(моль*К) Продукты реакции C2H5F(г) -297,0 364,8 58,6 Исходные вещества C2H4(г) 52,28 219,4 43,63 HF(г) –268,61 173,51 29,16 реакция -213,36 -28,11 -14,19 242 Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект реакции (∆rH) равен сумме теплот образования (∆fH) продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции ∆rH = ∑ ni∆fHпрод – ∑ nj∆fHисх Стандартная энтальпия образования ΔНобр – теплота, выделяемая или поглощаемая при образовании 1 моль вещества из простых веществ, его составляющих, при стандартных условиях. ∆rH = ∑ ni∆fHпрод – ∑ nj∆fHисх=-213,36 кДж/моль (см. табл.2.1) ∆Hr 0, или H – T S < 0. Значение этой функции (ее знак): G = H – T S и определяет направление процесса. Функция состояния системы G называется энергией Гиббса, или изобарноизотермическим потенциалом, или свободной энергией (устар.) системы. В системе в качестве самопроизвольного возможен только тот процесс, в результате которого энергия Гиббса системы уменьшается, G < 0. 243 На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислим ΔG 0 298 реакции, протекающей по уравнению. Вся система является газообразной, поэтому при расчете энергии Гиббса будем учитывать все элементы системы. Для расчета используем теплоты образования и энтропий веществ при стандартных условиях (Т=298К, р=1.13*105Па). Вычисления производим, используя следствия закона Гесса. Величина AG для той или иной реакции может быть определена по формуле: ΔGr = ΔGобр(продуктов) – ΔGoбp(реагентов). Вычислим ΔGr реакции используя ранее вычисленные энтальпию и энтропию реакции при стандартных условиях, Т=298К: ΔGr =∆Hr-Т*∆S 0 р-ции=-213,36-298*(-0,02811)≈-205 кДж/моль ΔGr <0 , следовательно, возможно протекание прямой самопроизвольной реакции при стандартных условиях. 2. Вычислим значение теплового (Н 0 ), изменение энтропии (S 0 ), изменение энергии Гиббса (G 0 ) и константу равновесия (K 0 ) при температуре Т = 398 К. 2.1 Изменение энтальпии




- Да. В соответствии со статьей 177 Трудового кодекса РФ гарантии и компенсации, связанные с обучением, предоставляются работнику при получении образования данного уровня впервые. В РФ в соответствии со ст. 27 Закона РФ «Об образовании» устанавливаются следующие образовательные уровни
- Завдання 5
- При некоторой температуре в системе 2SO3(г) = 2SO2(г) + О2(г) равновесные концентрации веществ равны соответственно 0,04, 0,12 и 0,06 моль/л Рассчитайте константу химического равновесия этой реакции Что можно сказать по ее величине о положении химического равновесия в данной системе?
- Для элементов, атомы которых образуют молекулу РН3 (вариант 18 в табл.2).
- Фирма "Карьер" осуществляла разработку месторождений полезных ископаемых.
- Пояснить обменный характер ядерных сил.
- Электролиз меди – химические реакции, состав электролита, добавки, конечная продукция, показатели.
- На основе данных таблицы 1: 1. Рассчитайте цену продажи стандартного номера при условии, что точка безубыточности гостиницы достигается при коммерческой загрузке номеров в 80%. 2. Определите продажные цены на все категории номеров в гостинице, исходя из следующей планируемой разницы в цене: номер «студия» - надбавка 50%, номер «люкс» - надбавка 100%, номер апартамент – надбавка 200%.
- Почему нейтрон, находясь в ядре, обладает отрицательной потенциальной энергией?
- Вычислите равновесные концентрации водорода и йода в реакции Н2 + I2 = 2HI. если их начальные концентрации составляли по 0,03 моль л, а равновесная концентрация йодоводорода [HI] = 0,04 моль/л Вычислите константу химического равновесия.
- На основе исходных данных определить следующие экономические показатели: 1) Издержки производства (цеховая себестоимость) 2) Полная себестоимость изделия
- Задача 6. В первом квартале предприятия реализовало продукции на 250 млн. руб., среднеквартальные остатки оборотных средств составили 25 млн. руб. Во втором квартале объем реализации продукции увеличится на 10%, а время одного оборота оборотных средств будет сокращено на один день.
- Вычислите AG тюз для реакции: Вао + SiO2 (В-кварц) - ВеО-SiO2 при температуре 1300 К. Ответ: -12,3 ккал/моль.
- Государственный орган экологического контроля зафиксировал залповый сброс нефтепродуктов в реку Малая Нева Судостроительным судоремонтным заводом.
