
Константа равновесия реакции А(г.)+В(г.) С(г.)+D(г.) равна единице. Сколько процентов вещества А подвергнется превращению, если смешать 3 моля вещества А и 5 молей вещества В. (Решение → 32754)
Заказ №38834
Константа равновесия реакции А(г.)+В(г.) С(г.)+D(г.) равна единице. Сколько процентов вещества А подвергнется превращению, если смешать 3 моля вещества А и 5 молей вещества В.
Решение:
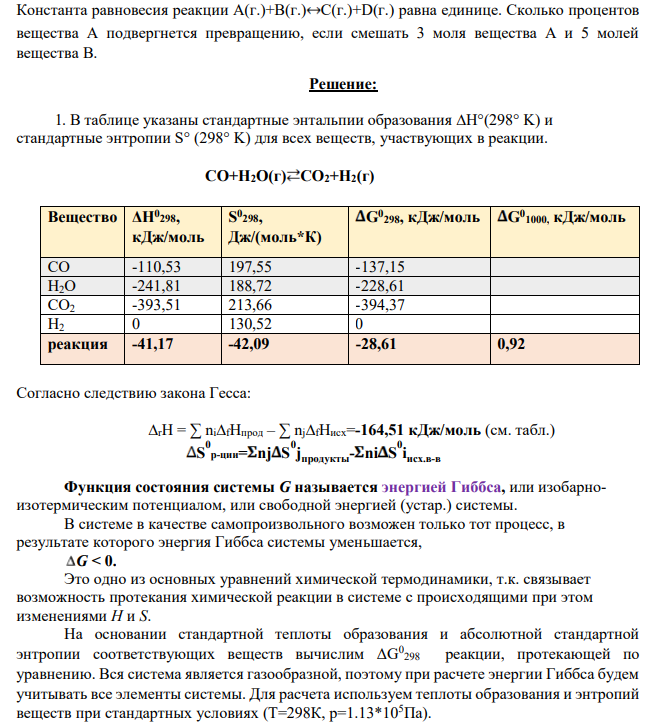
1. В таблице указаны стандартные энтальпии образования ∆H°(298° K) и стандартные энтропии S° (298° K) для всех веществ, участвующих в реакции. CО+H2O(г) CO2+H2(г) Вещество ΔН0 298, кДж/моль S 0 298, Дж/(моль*К) G0 298, кДж/моль G0 1000, кДж/моль CО -110,53 197,55 -137,15 H2O -241,81 188,72 -228,61 CO2 -393,51 213,66 -394,37 H2 0 130,52 0 реакция -41,17 -42,09 -28,61 0,92 Согласно следствию закона Гесса: ∆rH = ∑ ni∆fHпрод – ∑ nj∆fHисх=-164,51 кДж/моль (см. табл.) S 0 р-ции= nj S 0 j продукты- ni S 0 i исх.в-в Функция состояния системы G называется энергией Гиббса, или изобарноизотермическим потенциалом, или свободной энергией (устар.) системы. В системе в качестве самопроизвольного возможен только тот процесс, в результате которого энергия Гиббса системы уменьшается, G < 0. Это одно из основных уравнений химической термодинамики, т.к. связывает возможность протекания химической реакции в системе с происходящими при этом изменениями H и S. На основании стандартной теплоты образования и абсолютной стандартной энтропии соответствующих веществ вычислим ΔG 0 298 реакции, протекающей по уравнению. Вся система является газообразной, поэтому при расчете энергии Гиббса будем учитывать все элементы системы. Для расчета используем теплоты образования и энтропий веществ при стандартных условиях (Т=298К, р=1.13*105Па).

- Определите полную себестоимость производства одного шкафа и одной тумбочки по годовому плану мебельного комбината. Прямые затраты на продукцию мебельного цеха приведены в табл.
- При вынесении решения в совещательной комнате у судьи Арбитражного суда Краснодарского края возникли дополнительные вопросы к истцу и ответчику. Как должен поступить судья в этом случае? Обоснуйте свой ответ.
- Задача 2.1 Рассчитать показатель годового фонда времени работы оборудования Х. Оборудование эксплуатируется в непрерывном режиме, для него установлены следующие нормативы ППР: длительность ремонтного цикла – 34560 ч.,
- Две реакции протекают при температуре 250С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, второй -2,5. Найти отношение скоростей этих реакций при 950С.
- Дайте описание конформационных изомеров макромолекул.
- Образование циклических форм моносахаридов. Α- и β – изомеры моносахаридов (на примере глюкозы).
- Приведите реакции взаимодействия ацетоуксусного эфира со следующими реагентами: a) пентахлорид фосфора б) синильная кислота в) гидросульфит натрия г) гидроксид натрия д) фенилгидразин e) ацетилхлорид
- Предельная эквивалентная электропроводность синильной кислоты НСN при 0 25 равна 42,8 1 1 2 Ом кг экв м , а константа диссоциации - 10 7,9 10 . Чему равна удельная электропроводность раствора HCN, концентрация которого равна 0,2 3 кг экв / м ?
- К раствору FeCl3 добавили следующие вещества: а) HCl б)KOH в) ZnCl2 г) Na2CO3 В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте молекулярные и ионно-молекулярные уравнения гидролиза соответствующих солей.
- Различие биологической ценности белков семян и вегетативных органов растений, причины этого.
- В отчётном периоде предприятие выпустило изделий А в количестве 880 шт., изделий Б – 770 шт. Цена изделия А – 1000 руб., Б – 2000 руб.
- Банк «Кот» обратился в Арбитражный суд Краснодарского края с заявлением о выдаче судебного приказа о взыскании 10 млн руб. с банка «Звезда» на основании совершенного нотариусом протеста векселя в неплатеже. Плательщиком по векселю является банк «Звезда».
- Задача 5.4 На сборку одного прибора установлены нормы затрат рабочего времени: 16 нормоч. по IV разряду, 8 нормо-ч. по V разряду и 12 нормо-ч. по VI разряду.
- Инвестор с целью инвестирования рассматривает инвестиционный проект, который характеризуется следующими данными: Таблица 2 30 Характеристика инвестиционных проектов Денежные потоки, тыс. руб. Вариант 9 Инвестиционные затраты 7890 1 год - 2 год - Згод 5200 4 год 5200 5 год 5200 Коэффициент дисконтирования 11
