
В реакторе при постоянном объеме V = 1 м3 и температуреТ протекает газофазная реакцияА. В таблице 4.2.1 для этой реакции приведены результаты измерений общего давления реакционной смесиР в зависимости от времени её протекания t. (Решение → 26288)
Заказ №38753
Задание 4.2.1 В реакторе при постоянном объеме V = 1 м3 и температуреТ протекает газофазная реакцияА. В таблице 4.2.1 для этой реакции приведены результаты измерений общего давления реакционной смесиР в зависимости от времени её протекания t. На основании данных таблицы 4.2.1 исследуйте кинетику реакцииA и определите кинетические параметры: порядок реакции, константу скорости, период полупревращения. Выполняя задание, придерживаясь следующего плана действий: а) используя понятие о химической переменной ξ , выведите формулу, связывающую парциальное давление исходного вещества с общим давлением реакционной смеси; б) рассчитайте парциальное давление и молярную концентрацисходного вещества в реакции А указанные промежутки времени t; в) на основании результатов вычислений постройте графзависимостей С =f(t), lnС =f(t), 1/С =f(t), 1/С2 =fг) проведите анализ графических зависимостей и определите порядок реакцииА; д) определите порядок реакции методом подстановки; е) напишите кинетическое уравнение для реакцииА в дифференциальной и интегральной формах, вычислите значения константы скоростиk реакцииAв указанные промежутки времени. Проанализируйте полученные результаты и сделайте вывод. Еслиk меняется мало – усредните ее значение; ж) определите период полупревращения t1/2 и время t15% за которое прореагирует 15 % исходного вещества при температуре T; з) найдите концентрацию исходного вещества в момент времени t1 от начала реакции.
Решение:
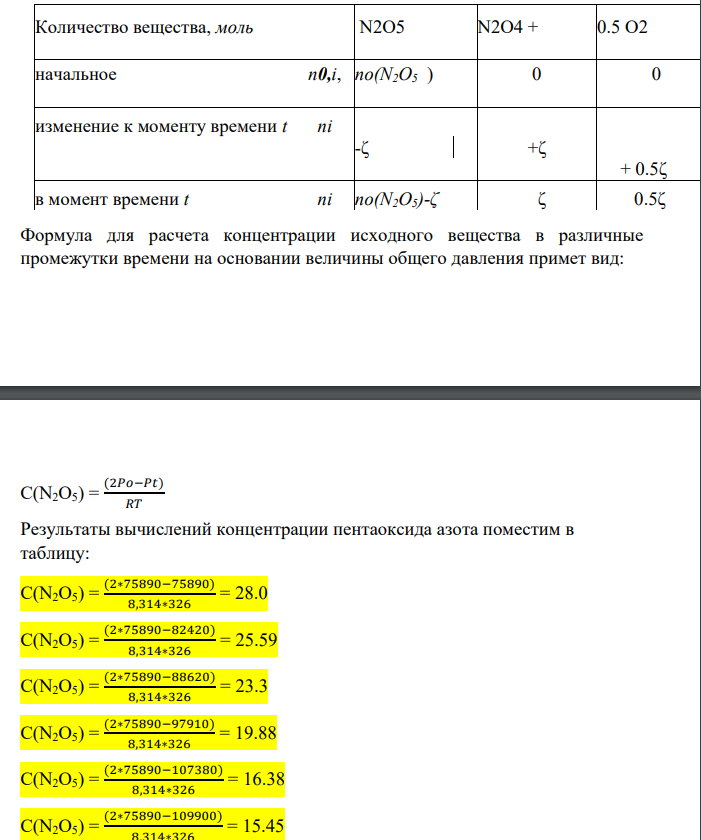
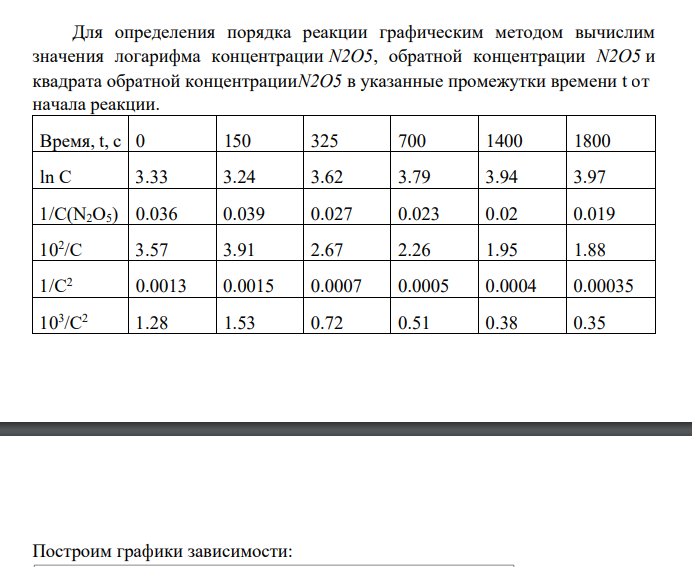
Рассмотрим решение задания на примере реакции N2O5 = N2O4 + 0.5O2 Для идеального газа параметры состояния связаны уравнением Клапейрона-Менделеева, из которого следует: n = PV/RT ∆n(N2O5) = - α ∆n(N2O4) = + α ∆n(O2) = + 0.5α Количество вещества, моль N2O5 N2O4 + 0.5 O2 начальное n0,i, no(N2O5 ) 0 0 изменение к моменту времени t ni -ζ +ζ + 0.5ζ в момент времени t ni no(N2O5)-ζ ζ 0.5ζ Формула для расчета концентрации исходного вещества в различные промежутки времени на основании величины общего давления примет вид: С(N2O5) = (2𝑃𝑜−𝑃𝑡) 𝑅𝑇 Результаты вычислений концентрации пентаоксида азота поместим в таблицу: С(N2O5) = (2∗75890−75890) 8,314∗326 = 28.0 С(N2O5) = (2∗75890−82420) 8,314∗326 = 25.59 С(N2O5) = (2∗75890−88620) 8,314∗326 = 23.3 С(N2O5) = (2∗75890−97910) 8,314∗326 = 19.88 С(N2O5) = (2∗75890−107380) 8,314∗326 = 16.38 С(N2O5) = (2∗75890−109900) 8,314∗326 = 15.45 Время, t, c 0 150 325 700 1400 1800 Общее давление при Т = 326 К Ро = 75890 82420 88620 97910 107380 109900 С(N2O5), моль/м3 28.0 25.59 23.3 19.88 16.38 15.45 Для определения порядка реакции графическим методом вычислим значения логарифма концентрации N2O5, обратной концентрации N2O5 и квадрата обратной концентрацииN2O5 в указанные промежутки времени t от начала реакции. Время, t, c 0 150 325 700 1400 1800 ln C 3.33 3.24 3.62 3.79 3.94 3.97 1/С(N2O5) 0.036 0.039 0.027 0.023 0.02 0.019 102 /C 3.57 3.91 2.67 2.26 1.95 1.88 1/C2 0.0013 0.0015 0.0007 0.0005 0.0004 0.00035 103 /C2 1.28 1.53 0.72 0.51 0.38 0.35 Построим графики зависимости:



- На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7. Ответ: на 45,3 0C.
- С предложенными в таблице 1 комплексными ионами составьте формулы двух комплексных соединений. Назовите их. Укажите в этих соединениях комплексообразователь, лиганды, координационное число, внешнюю и внутреннюю сферу.
- Первоначальная стоимость нефтяной скважины 30 млн. руб. Срок полезного использования 15 лет. За первый год эксплуатации среднесуточный дебит составил 68 т/сут. Коэффициент эксплуатации 0,87,
- Составьте электронно-ионные уравнения процессов окисления и восстановления. Расставьте коэффициенты в уравнениях реакций.
- Составьте гальванический элемент, в котором протекает самопроизвольно химическая реакция А (табл. 3.5). Напишите уравнение, связывающее стандартное изменение энергии Гиббса ДGТ в ходе химической реакции, протекающей в гальваническом элементе, со стандартным значением ЭДС гальванического элемента при температуре Т (табл. 8.4).
- Первоначальная стоимость нефтяной скважины 30 млн. руб. Срок полезного использования 15 лет. За первый год эксплуатации среднесуточный дебит составил 68 т/сут.
- Почему молекула CF4 имеет тетраэдрическую, COF2 – треугольную, a CO2 – линейную форму? Каково гибридное состояние валентных орбиталей атома углерода в данных молекулах?
- Составить гальванический элемент из двух оловянных пластин, опущенных в растворы SnCl2. Концентрация одного раствора 0,01 моль/дм3 , другого раствора – 1 моль/л. Составить схему гальванического элемента. Рассчитать ЭДС гальванического элемента.
- Для определения в воде NО3 - -ионов используют стандартный раствор KNО3 c T(NO3 − ) = 0,01 мг/ см3 . Пробы в интервале 0,10 ÷ 0,80 см3 обработали необходимыми реактивами, прибавили хромотроповую кислоту и довели до 10,00 см3 концентрированной H2SO4 .
- Для определения меди в цветном сплаве из навески 0,325 г после растворения и обработки аммиаком было получено 250 мл окрашенного раствора, оптическая плотность которого в кювете с толщиной слоя 2 см была 0,254. Определить содержание меди в сплаве (в %), если молярный коэффициент поглощения аммиаката меди равен 423.
- Составьте ионно-молекулярные и молекулярные уравнения гидролиза, происходящие при смешивании следующих пар растворов: а) нитрата хрома(Ш) и сульфида натрия ; б) сульфата меди(П) и карбоната калия.
- Определение параметров температурной зависимости скорости химической реакции В таблице 4.2.6 приведены значения констант скоростей k1 и k2 для реакции A (см. таблицу 4.2.1) при температурах T1 и T2, соответственно.
- Составьте молекулярные и молекулярно-ионные реакции взаимодействия между: а) сульфатом меди и гидроксидом натрия; б) сульфитом натрия и серной кислотой; в) сульфатом кадмия и сульфитом натрия.
- Рассчитайте молярную концентрацию эквивалента и титр йодида калия, 1 литр которого содержит 0,0037 кг йодида калия. Ответ: 0,02 моль/л.
